Medizin-Nobelpreis
Wie Zellen mit Sauerstoffmangel leben können
Drei Grundlagenforscher teilen sich den diesjährigen Medizin-Nobelpreis. Ihre Erkenntnisse haben bereits die Entwicklung von Medikamenten gegen Anämie und Krebs vorangebracht.
Veröffentlicht:
Die Medizin-Nobelpreisträger 2019: Professor Gregg L. Semenza (Baltimore), Professor Peter J. Ratcliffe (London) und Professor William G. Kaelin Jr. (Boston, v. l n. r).
© Nobel Prize Committee
Stockholm. Der diesjährige Nobelpreis für Medizin oder Physiologie geht an William G. Kaelin Jr. vom Dana-Farber Cancer Institute in Boston, Sir Peter J. Ratcliffe vom Francis Crick Institute in London sowie Gregg L. Semenza vom Johns Hopkins Institute for Cell Engineering in Baltimore.
Geehrt werden sie „für ihre Entdeckungen, wie Zellen die Sauerstoffverfügbarkeit wahrnehmen und sich daran anpassen“, teilte das Nobelpreiskomittee am Karolinska-Institut am Montag in Stockholm mit.
Den Forschern ist es gelungen, den Mechanismus zu entschlüsseln, der die Aktivität von Genen als Reaktion auf das unterschiedliche Sauerstoffangebot in Zellen und Geweben reguliert. Die bekannteste Reaktion auf Sauerstoffmangel etwa ist die vermehrte Synthese von Erythropoietin (EPO), wodurch die Erythropoese angekurbelt wird.
HIF ist zentrales Element
Zentrales Element ist hier der Proteinkomplex HIF (hypoxia-inducible factor), den Semenza Anfang der 1990er-Jahre entdeckte. Ein Teil davon ist HIF-1-alpha, ein Faktor, der an DNA bindet und so unter anderem die EPO-Produktion in der Niere reguliert. Gemeinsam mit Ratcliffe erforschte Semenza die Regulation des EPO-Gens genauer, das etwa bei der Entstehung der Anämie oder für Bergsteiger von Bedeutung ist.
Der Krebsforscher Kaelin interessierte sich damals besonders für das vererbte Von-Hippel-Lindau-Syndrom (VHL), bei dem das mutierte Gen, ein Tumorsuppressor-Gen, das Ansprechen auf eine Hypoxie kontrolliert.
In der Folge stellte sich heraus, dass für das Ansprechen auf die jeweilige Sauerstoffkonzentration ein Zusammenspiel zwischen dem VHL-Gen sowie dessen Eiweißprodukt und dem HIF-1-alpha erforderlich ist.
Unter physiologischen Sauerstoffbedingungen wird HIF-1-alpha in Kooperation mit dem VHL-Komplex in relativ kurzer Zeit in den Proteasomen, den Müllschluckern der Zelle, abgebaut. Sinkt die Sauerstoffkonzentration dagegen und kommt es zur Hypoxie, ist HIF-1-alpha vor dem Abbau geschützt und kann gemeinsam mit einem zweiten Faktor an spezifischen Stellen in der DNA des Zellkerns binden.
Regulation der Genaktivität
Die Stellen auf der DNA des EPO-Gens werden mit dem Kürzel HRE bezeichnet, was für „hypoxia/hormone response element“ steht. Darüber läuft die Regulation der Genaktivität. Kontrolliert wird die Stabilität des HIF-1-alpha durch das Enzym Prolin-Hydroxylase, das HIF durch Hydroxylierung markiert und dadurch dessen Abbau einleitet.
Wie Professor Randall S. Johnson von der University of Cambridge und vom Karolinska-Institut in Stockholm bei der Bekanntgabe sagte, haben die Preisträger einen eleganten Schalter entdeckt. Heute seien mindestens 300 Gene bekannt, die die HRE-Region enthielten. „Alle werden durch HIF reguliert, damit Zellen und Gewebe sich an die sich ständig ändernden Sauerstoffspiegel anpassen können.“
Unter diesen Genen befindet sich etwa jenes für das Protein VEGF (vascular endothelial growth factor), das die Gefäßneubildung reguliert und gegen das bereits Antikörper für die Therapie verfügbar sind, und natürlich für EPO. Auch fast alle Gene der Enzyme, die in der Glykolyse involviert sind, gehören dazu.
Erkenntnisse für Arzneientwicklung genutzt
Zu den Störungen, für die die Aktivität von HIF von pathophysiologischer Bedeutung ist, gehören außer Anämie und Krebs – über die Gefäßneubildung – auch Schlaganfall, Herzinfarkt, Infektionen und gestörte Wundheilung. Die gewonnenen Erkenntnisse werden bereits für die Entwicklung von Arzneien genutzt.
Dabei geht es etwa um die Erhöhung der HIF-1-alpha-Spiegel, etwa um Patienten mit Anämie zu behandeln. Dies versucht man durch die Entwicklung von Hemmstoffen der Hydroxylase zu erreichen. Solche HIF-Inhibitoren haben bereits das Stadium der klinischen Phase III erreicht.
Eine andere Strategie sind Präparate, die diese Spiegel senken, um Patienten mit Krebs zu behandeln. Solche HIF-2-alpha-Antagonisten werden in Phase II unter anderem bei Nieren- und ZNS-Tumoren geprüft.
Johnson: „Die diesjährigen drei Lauraten haben unser Wissen darüber erweitert, wie physiologische Reaktionen Leben überhaupt möglich machen.“
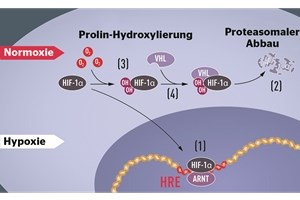
Bei Hypoxie wird HIF-1α vor Abbau geschützt und akkumuliert im Zellkern, wo es zusammen mit dem Transkriptionsfaktor ARNT an eine spezifische DNASequenz (HRE) bindet. Bei Normoxie wird HIF-1α schnell vom Proteasom abgebaut (2). Der Prozess wird vom Sauerstoff über die Hydroxylierung von HIF-1α reguliert. Das VHL-Protein kann daraufhin einen Komplex mit HIF-1α bilden, was zum Abbau im Proteasom führt. Nobel Committee /Mattias Karlén
© Nobel Committee / Mattias Karlén






