Axiale Spondyloarthritis
Die Krux mit Bildgebung und Labortest
Medikamente einem vorab gesetzten Ziel anpassen und im Verlauf nicht einfach „durchverordnen“: Das wünscht sich PD Dr. Uta Kiltz, eine der federführenden Autoren der aktualisierten S3-Leitlinie zur axialen Spondyloarthritis. Zu achten ist auch auf Komorbiditäten wie Osteoporose.
Veröffentlicht: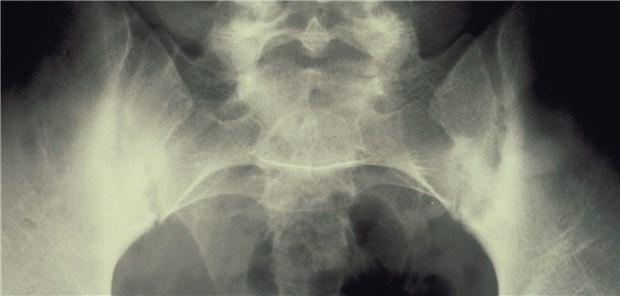
Bei axSpA kommt es zu zunehmender Verknöcherung der Wirbelsäule und in den Sakroiliakalgelenken.
© Prof. H. S. Füeßl, München
Ärzte Zeitung: Frau Dr. Kiltz, es gab international Änderungen der Bezeichnungen und der Klassifizierung von Spondyloarthritiden. Sind „axiale Spondyloarthritis“ (axSpA) und „Morbus Bechterew“ Synonyme?
Privatdozentin Dr. Uta Kiltz: Nein. Die Gesamtgruppe „axiale Spondyloarthritis“ ist charakterisiert durch entzündliche Rückenschmerzen und eine im Laufe der Zeit zunehmende Verknöcherung der Wirbelsäule und in den Sakroiliakalgelenken. Entsprechend der modifizierten New-York-Kriterien wird die Bezeichnung „Morbus Bechterew“ erst im fortgeschrittenen Stadium radiologisch sichtbarer Veränderungen in den Sakroiliakalgelenken genutzt, genauer: wenn die Verknöcherung mit einem Grad 2 beidseits oder mit einem Grad 3 einseitig festgestellt worden ist. Davon unterscheiden wir eine Frühform, die „nichtröntgenologische Form“ der axialen Spondyloarthritis.
International ist der Begriff „Bechterew“ nur in wenigen Ländern gebräuchlich. Es wird von „röntgenologischer axialer Spondyloarthritis“ gesprochen, im angloamerikanischen Sprachraum von „ankylosierender Spondylitis“.

PD Dr. Uta Kiltz ist Oberärztin am Rheumazentrum Ruhrgebiet am Marien Hospital in Herne.
© Rheumazentrum Ruhrgebiet
Bei welchen Patienten gilt es daran zu denken, dass kein unkompliziertes Rückenschmerzproblem vorliegt?
Wenn die Patienten jünger als 45 Jahre alt sind, die Rückenschmerzen länger als drei Monate anhalten und wenn der Schmerzcharakter vom entzündlichen Typ ist. Diese Patienten klagen überwiegend nachts oder morgens über Rückenschmerzen und die Schmerzen werden mit Bewegung besser.
Diese Charakteristika sind damit entscheidend für die Abgrenzung zum mechanischen Rückenschmerz.
Wonach fragen Sie Ihre Patienten im Erstkontakt noch?
Psoriasis, chronisch-entzündliche Darmerkrankungen oder die Uveitis sind häufige extraskelettale Manifestationen der axSpA. Patienten mit einer Achsenskelettmanifestation haben mit einem Anteil von bis zu 40 Prozent zusätzlich eine asymmetrische Oligoarthritis in bis zu vier Gelenken, bevorzugt an der unteren Extremität. Auch eine Enthesitis tritt bei vielen Patienten mit axialer SpA auf.
Wie sieht das Geschlechterverhältnis bei der Erkrankung aus?
Wir gehen heute nicht mehr von einer männerlastigen Manifestation aus. Das Verhältnis der von axSpA betroffenen Frauen und Männer ist ungefähr gleich. Frauen haben in Bezug auf die Verknöcherungen allerdings einen oft eher milden Verlauf und erfüllen damit nicht so oft die Kriterien für einen Morbus Bechterew wie Männer.
Frauen haben dafür vergleichsweise mehr Halswirbelsäulenbeschwerden. Die Krankheitslast in Bezug auf Schmerzen und Steifigkeit der Wirbelsäule insgesamt ist ausgeglichen.
Reicht für die Initial-Bildgebung eine Röntgenaufnahme des Beckens oder der Wirbelsäule aus?
In der axSpA-Leitlinie geben wir keine einheitlich gestufte Empfehlung für die Bildgebung ab. Die Leitlinie empfiehlt ein individuelles Vorgehen unter Berücksichtigung der bereits vorliegenden bildgebenden Diagnostik und in Absprache mit einem Rheumatologen.
Da zu Beginn der Erkrankung bevorzugt entzündliche Veränderungen vorliegen, wäre hier die Kernspintomografie die adäquate Bildgebung. Die damit detektierbaren Entzündungszeichen sind allerdings nicht spezifisch für die axSpA. Sie können auch durch mechanische Belastungen hervorgerufen worden sein.
Die Röntgenaufnahme hat daher ihren Stellenwert bei der Differenzialdiagnose, da zum Beispiel Gleitwirbel oder ein inkompletter Bogenschluss der Wirbelsäule vorliegen könnte. Hinweisen möchte ich außerdem auf die schwierige Interpretation röntgenologisch sichtbarer Strukturveränderungen an den Sakroiliakalgelenken. Diese Veränderungen zuverlässig zu quantifizieren ist nicht einfach, wie dies anhand von Studien mehrfach gezeigt werden konnte.
Welche Labor-Diagnostik ist hilfreich?
Es gibt keinen bestätigenden Labortest für die axSpA. Ein positiver HLA- B27-Befund ist nur als Hinweis im Kontext weiterer Befunde zu werten. 10 Prozent der deutschen Bevölkerung sind HLA-B27-positiv, die Prävalenz der axSpA liegt bei einem Prozent. Umgekehrt spricht ein negatives Ergebnis nicht gegen das Vorliegen einer entzündlichen Wirbelsäulenerkrankung.
Wir empfehlen zudem die Messung des C-reaktiven Proteins(CRP): Zwar stützt ein hoher Wert den Verdacht auf eine entzündliche Wirbelsäulenerkrankung. Andererseits haben bis zu zwei Drittel der axSpA-Patienten keinen erhöhten CRP-Wert.
Welchen Patienten schicke ich als Hausarzt zum Rheumatologen?
Je mehr der genannten Symptome und Kriterien für eine axSpA sprechen, desto eher sollte eine Überweisung erfolgen. Bis zum Termin beim Rheumatologen kann ein solcher Patient mit NSAR anbehandelt werden. Denn das ist die Therapie der ersten Wahl und sie hat außerdem diagnostische Aussagekraft – entzündliche Rückenschmerzen werden meist gut darauf ansprechen im Unterschied zu mechanisch ausgelösten Schmerzen.
Sehr wichtig ist dabei, sofort – sofern keine Kontraindikationen vorliegen – mit der maximalen NSAR-Dosis zu behandeln, also zum Beispiel 150 mg Diclofenac pro Tag. Es können alle traditionellen NSAR oder Coxibe eingesetzt werden. Diese Therapie muss oft über mehrere Wochen gegeben werden.
Können Sie bitte die Grundzüge der Therapie skizzieren?
Wir brauchen stets gleichberechtigt eine medikamentöse und eine nichtmedikamentöse Therapie. Letztere umfasst die Patientenschulung, Bewegung, Physiotherapie, gegebenenfalls auch Rehabilitation. Die NSAR werden bei hoher Krankheitsaktivität als Mittel der ersten Wahl angesehen.
Nach 2 Wochen kann sicher abgeschätzt werden, ob sich eine Verbesserung der Schmerzsymptomatik eingestellt hat. Wenn sich unter dem ersten NSAR keine wesentliche Verbesserung einstellt, sollte ein zweites NSAR, ebenfalls in maximaler Dosierung, verordnet werden. Tritt hierunter ebenfalls keine Schmerzreduktion ein, wechseln wir zügig auf Biologika – für die axSpA sind TNF-Blocker und Interleukin (IL)-17-Inhibitoren zugelassen.
Die TNF-Blocker sind für alle axSpA-Formen zugelassen, die IL17-Inhibitoren im Moment nur für die röntgenologische axSpA. Wir erwarten aber in Zukunft die Indikationserweiterung für die IL17-Inhibitoren.
Wie lange soll denn die NSARTherapie fortgesetzt werden, wenn ein Patient gut darauf anspricht?
Das soll individualisiert und gemeinsam mit dem Patienten entschieden werden. Wenn der Patient von der Therapie profitiert hat, wird er häufig bereits selbständig eine Dosisreduktion vornehmen und gegebenenfalls auf eine Bedarfsmedikation umstellen.
Bei Patienten mit hoher Krankheitsaktivität funktioniert das Absetzen der NSAR jedoch nicht, so dass wir oft recht schnell auf Biologika wechseln müssen. Die Indikation für Biologika ist auch bei NSAR-Unverträglichkeiten und Kontraindikationen gegeben.
Was, wenn zusätzlich eine periphere Manifestation vorliegt?
Dann haben langfristig Sulfasalazin und Methotrexat ihren Stellenwert, ebenso wie Glukokortikoide, bevorzugt als lokale Applikation. Für alle genannten Substanzen ist die Datenlage bezüglich der Wirksamkeit im Vergleich zu Biologika jedoch schwach.
Wir haben uns in der Leitlinie klar gegen eine längerfristige systemische Glukokortikoid-Therapie bei Achsenskelettmanifestation ausgesprochen. Denn erst hohe Dosierungen hätten einen Nutzen, diese können wir aber wegen der bekannten Nebenwirkungen nicht für längere Zeit geben.
Sie sprachen Bewegung und Physiotherapie an ...
Damit meinte ich nicht nur die Einzelkrankengymnastik. Es geht um die gesteigerte körperliche Aktivität im Alltag, sportliche Aktivitäten, Funktionstraining oder Rehasport, gerne auch in Gruppen. Es ist unsere Aufgabe, die Patienten regelmäßig dazu zu ermuntern und zu motivieren.
Die Leitlinie sagt aber nicht, welche einzelnen Interventionstechniken notwendig sind. Wir nehmen allerdings zu Manipulationen an der Wirbelsäule Stellung. Da ist angesichts der entzündlichen Veränderungen der Knochen Vorsicht geboten.
Gibt es Kriterien, mit denen sich der weitere Krankheitsverlauf abschätzen lässt?
Es gibt leider keine zuverlässigen Prognoseschätzer. Einige Faktoren sprechen für einen schwerwiegenden Verlauf: männliches Geschlecht, knöcherne Strukturschäden bereits zu Beginn der Erkrankung, erhöhte Entzündungsparameter und das Rauchen. Festzustellen ist außerdem, dass uns für die axSpA bislang keine Therapien zur Verfügung stehen, die einen kompletten Stopp der radiologischen Progression bewirken. Was wir erreichen können, ist eine Verlangsamung des Fortschreitens der Erkrankung.
Welche Aspekte sind in der langfristigen Versorgung von axSpAPatienten noch bedeutsam?
Mir sind zwei Dinge wichtig: Wir müssen regelmäßig nach Komorbiditäten wie Bluthochdruck oder Infektionen schauen. Osteoporose ist die am häufigsten nicht erkannte Komplikation einer axSpA. Daher sollte einmal jährlich in Absprache zwischen Hausarzt und Rheumatologen ein Screening auf Komorbiditäten stattfinden.
Zweitens wünschen wir uns, dass Medikamente nicht blind dauerhaft „durchverordnet“ werden. Wir verfolgen ein Treat-to-Target-Konzept: Zielparameter ist die Krankheitsaktivität. Erreiche ich ein vorgesehenes Ziel nicht, muss ich die Medikation ebenso anpassen, wie ich bei Remission auch deeskalieren kann.
Womit lässt sich die Krankheitsaktivität messen?
In der Regel wird das der Rheumatologe übernehmen. Sehr einfach anzuwenden ist der Selbstauskunftsbogen BASDAI (Bath Ankylosing Spondylitis Disease Activity Index). Das sind sechs zu beantwortende Fragen – liegt die erzielte Punktzahl unter 4, liegt keine erhöhte Krankheitsaktivität vor.
Bereits in der Präambel der Leitlinie betonen Sie die Bedeutung der Durchimpfung der Patienten gemäß STIKO-Empfehlungen ...
Jeder Patient mit entzündlich-rheumatischen Erkrankung ist per se infektanfällig. Die Biologika-Therapie, die bei etwa der Hälfte der axSpAPatienten nötig ist, supprimiert das Immunsystem zusätzlich. Wir wissen aus vielen Studien, dass die Durchimpfungsraten bei Patienten mit entzündlich-rheumatischen Erkrankungen schlechter als in der Allgemeinbevölkerung sind.
Deshalb weisen wir nachdrücklich auf die Notwendigkeit der Standardimpfungen hin. Das Robert Koch-Institut hat außerdem spezifische Empfehlungen für immunsupprimierte Patienten formuliert.
PD Dr. Uta Kiltz
- Aktuelle Position: Oberärztin am Rheumazentrum Ruhrgebiet am Marien Hospital in Herne, Universitätsklinik der Ruhr-Universität Bochum
- Werdegang: Medizinstudium in Greifswald und Bochum, Facharztweiterbildung zur Internistin am Katholischen Klinikum der Ruhr-Universität Bochum, ab 2010 Funktionsoberärztin am Rheumazentrum Ruhrgebiet Herne und ab 2012 Oberärztin, 2018 Habilitation
- Engagement: Koordination der S2e-Leitlinie „Gichtarthritis – fachärztliche Versorgung“; gemeinsam mit Professor Jürgen Braun (Herne) federführende Autorin der S3-Leitlinie „Axiale Spondyloarthritis inklusive M. Bechterew und Frühformen“




