Galenus 2017
Diese 5 Forscherteams haben sich um den Galenus-Preis beworben

Die Galenus-Medaille.
© David Vogt
Altersforschung TU München
Wirkung Sulforaphan auf Fibroblasten © Karima Djabali
© Karima Djabali
Sulforaphan als Medikament bei Hutchinson-Progerie
Das Hutchinson-Gilford-Syndrom (HGPS) ist eine seltene, nicht heilbare Erkrankung bei Kindern. Die Ursache ist eine Veränderung der Erbanlage für das Zellkerneiweiß Lamin A/C: Bei HGPS-Patienten kommt es aufgrund einer Mutation zur Bildung eines verkürzten Eiweißes, des Progerins. Die Folge ist ein vorzeitiger Alterungsprozess in verschiedenen Organsystemen wie Haut, Skelett und Blutgefäßen. Die Betroffenen bleiben kleinwüchsig, leiden oft an Osteoporose und Arterienverkalkung und versterben noch vor dem 15. Lebensjahr. Wie die Garchinger Forscher anhand eines Vergleichs der Zellkerneiweiße von Fibroblasten gesunder Personen und HGPS-Patienten zeigen konnten, geht die Bildung von Progerin mit einer Reihe von Veränderungen der Eiweiße einher, die am Abbau und an der Wiederverwertung von Zellbestandteilen beteiligt sind (Aging Cell 2015;14:78-91). Die Behandlung der HGPS-Fibroblasten mit dem Isothiocyanat Sulforaphan konnte das Eiweißprofil beim Gesunden wiederherstellen. Dabei stimulierte Sulforaphan den Eiweißumsatz und förderte den Abbau von Progerin, wodurch langfristig auch HGPS-typische Veränderungen im Wachstum und Erscheinungsbild der Zellen rückgängig gemacht werden konnten.
Immunologie Klinikum Münhen
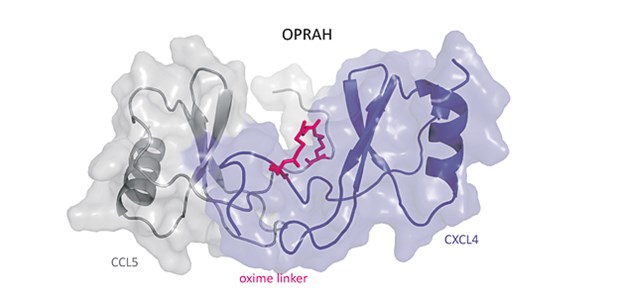
Interaktion Chemokine © Philipp von Hundelshausen
© Philipp von Hundelshausen
Chemokin-Interaktion: Erste molekularbiologische Kartierung
Chemokine sind Signaleiweiße, die die Wanderung weißer Blutkörperchen steuern. Homöostatische Chemokine werden ständig produziert und sichern dadurch die Überwachung des Körpers durch Zellen der Immunabwehr. Inflammatorische Chemokine hingegen werden erst bei Verletzung von Geweben freigesetzt und locken weitere Immunzellen an. Chemokine spielen eine Rolle bei Krankheiten, die auf chronischen Entzündungen beruhen. Chemokin-Moleküle fügen sich zu Paaren, sogenannten Dimeren, zusammen. Die Verbindung gleichartiger Chemokine wird Homodimer genannt. Sind die Bindungspartner unterschiedlich, spricht man von Heterodimeren. Mithilfe molekularbiologischer und spektroskopischer Methoden untersuchten die Münchner Forscher erstmals, welche der etwa 50 bekannten Chemokine miteinander interagieren und welche Auswirkungen die Interaktion auf ihre Funktion hat (Sci Transl Med 2017; 9:eaah6650). Dabei fanden sie heraus, dass insbesondere inflammatorische Chemokine zur Dimerbildung neigen. Dimere vom sogenannten CC-Typ verstärken die Chemokin-Wirkung, Dimere vom CXC-Typ hingegen hemmen sie. Mithilfe künstlicher Eiweiße konnten die Forscher im Mausmodell die Bildung von CC-Heterodimeren gezielt beeinflussen und die fördernde Wirkung auf Atherosklerose, Entzündungsprozesse in der Lunge und die Zusammenlagerung von Blutplättchen unterbinden.
Neurologie Uni Ulm
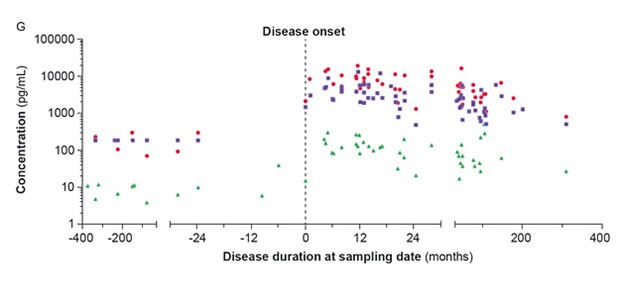
Neurofilamente als Biomarker © Markus Otto
© Markus Otto
Neurofilamente als Biomarker für die ALS-Diagnose
Die Amyotrophe Lateralsklerose (ALS) ist eine seltene Nervenerkrankung. Betroffen sind die Motoneurone, jene Nervenzellen, die die Bewegung der Skelettmuskeln kontrollieren. Die Schädigung und der Verfall der Motoneurone führen zu fortschreitender Muskelschwäche und zu Muskelschwund. Die Diagnose der ALS erfolgt anhand der klinischen Symptome, wobei der Erkrankungsbeginn oft übersehen wird. Patienten versterben meist drei Jahre nach Auftreten der Symptome. Auf der Suche nach einem Biomarker für einen diagnostischen Test konzentrieren sich die Ulmer Forscher auf die Neurofilamente, Struktureiweiße der Nervenzellen. Hierzu ermittelten sie die Neurofilamentkonzentrationen im Liquor von 455 Patienten mit ALS und verschiedenen anderen Nervenerkrankungen (J Neurol Neurosurg Psych 2016; 87:12-20). Dabei konnten sie Grenzwerte für Konzentrationen der leichten und schweren Neurofilamentketten definieren, anhand derer sich Erkrankte mit hoher Sicherheit identifizieren lassen. Im Vergleich symptomatischer und asymptomatischer Träger einer erblichen Veranlagung für ALS zeigten sie zudem, dass asymptomatische Träger unauffällige Konzentrationen der Neurofilamente sowohl im Liquor als auch im Blutserum aufweisen (Ann Neurol. 2016; 79(1):152-8). Mit Beginn der ALS-Symptomatik steigt der Wert an. Der Anstieg lässt Rückschlüsse auf den weiteren Verlauf der Erkrankung und die Prognose der Patienten zu.
Onkologie TU München
Antitumorwirkung immunmodulierender Substanzen © Florian Bassermann
© Florian Bassermann
Aufklärung des Wirkmechanismus immunmodulierender Substanzen
Zu den immunmodulierenden Substanzen (IMiDs) gehören Thalidomid und seine Nachfolgesubstanzen Lenalidomid und Pomalidomid. Sie werden erfolgreich in der Therapie von bösartigen Erkrankungen des blutbildenden Systems eingesetzt. Der genaue Wirkmechanismus der IMiDs war lange Zeit unbekannt, wobei neuere Untersuchungen auf eine Beteiligung des Zelleiweißes Cereblon (CRBN) hindeuten, das eine Rolle im Eiweißabbau spielt. Die Münchner Forscher untersuchten die Interaktion von CRBN mit den Zelleiweißen CD147 und MCT1, die einen Komplex in der Zellmembran bilden, der verschiedene Stoffwechselprozesse steuert, wie sie typisch für Tumorzellen sind (Nat Med. 2016;22:735-43). Dabei entdeckten sie, dass CRBN als sogenanntes Chaperon-Eiweiß fungiert und die korrekte Faltung und Reifung von CD147 und MCT1 sichert. IMiDs vermitteln ihre Antitumoraktivität dadurch, dass sie in sensiblen Zellen CD147 und MCT1 von CRBN verdrängen. Untersuchungen an Tiermodellen bestätigten diese Ergebnisse. Dabei erklärt die Destabilisierung des Eiweißkomplexes durch IMiDs nicht nur das verringerte Wachstum von Tumorzellen, sondern liefert auch eine Erklärung für das Potenzial von Thalidomid, bei einem Organismus Fehlbildungen hervorzurufen.
Zellbiologie Uni Münster
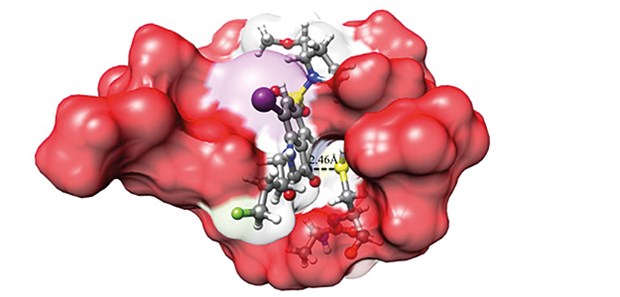
Synthese halogenierter Isatin-Sulfonamide © Günter Haufe
© Günter Haufe
Apoptose-Forschung: Entwicklung halogenierter Isatin-Sulfonamide
Das Gleichgewicht zwischen Zellwachstum und -sterben ist essenziell für die Entwicklung mehrzelliger Lebewesen. Reguliert wird es über den programmierten Zelltod, die sogenannte Apoptose. Dieser Mechanismus ermöglicht eine kontrollierte Zerstörung überzähliger, geschädigter oder potenziell gefährlicher Körperzellen. Störungen der Apoptose können beim Menschen zur Entstehung der Alzheimer-Krankheit oder von Krebs beitragen. Gesteuert wird die Apoptose über verschiedene Signalwege im Zellinneren. Eine Schlüsselfunktion kommt dabei eiweißspaltenden Enzymen zu, den sogenannten Effektor-Caspasen-3 und -7. Sie gelten als Ansatzpunkt, sowohl für eine therapeutische Beeinflussung der Apoptose als auch für ihre Darstellung durch bildgebende Verfahren auf Molekülebene. Im Blickpunkt der Münsteraner Forscher stehen Isatin-Sulfonamide. Diese niedermolekularen Substanzen sind Hemmer der Caspasen-3 und -7. Im Labor stellten die Wissenschaftler 22 neue Verbindungen aus Isatin-Sulfonamiden und Halogenen wie Fluor her (J Med Chem 2014; 57:9383-9395). Dabei zeigten sie, dass eine Fluorierung die Stärke der Caspasehemmung erhöhen kann. Radioaktiv markierte Neusubstanzen erwiesen sich im Tiermodell als stabil im Blutserum. Das macht sie als sogenannter Tracer für die molekulare Bildgebung verfügbar.




