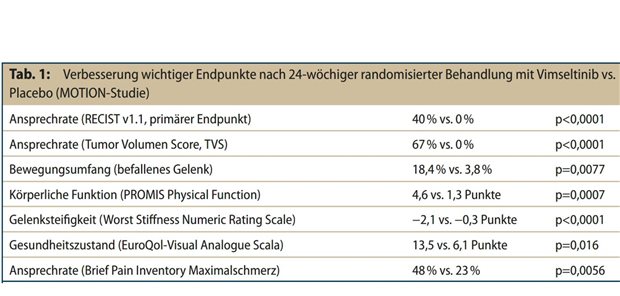
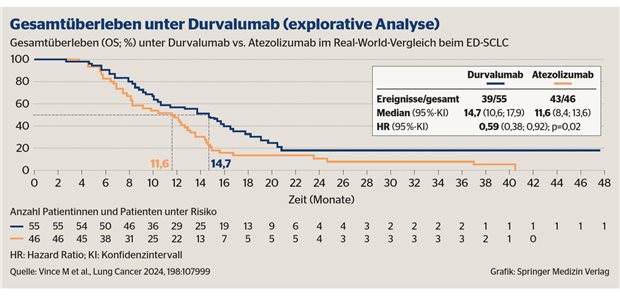
Arzneitherapie
Biosimilar-Einsatz erfordert präzise Dokumentation
Bei Rituximab stehen seit Kurzem erstmals monoklonale Antikörper für die Krebstherapie zur Verfügung, Trastuzumab wird bald folgen. Für verordnende Ärzte heißt das vor allem: Patienten umfassend aufklären und die Arzneitherapie akribisch dokumentieren.
Veröffentlicht:BERLIN. Gemessen an chemischen Generika haben Biosimilars einen schweren und langsamen Start: Erst 2014 überstieg der Umsatz die 100-Millionen-Euro-Marke. Dieses Jahr wird er voraussichtlich mehr als 400 Millionen Euro überschreiten, vor allem, weil 2015 mit TNF-alpha ein Blockbuster-Biological patentfrei und Biosimilars zugelassen wurden.
Aber: Der Marktanteil des TNF- alpha-Biosimilars wird dieses Jahr gerade einmal die Zehn-Prozent-Marke dieses Wirkstoffs erreichen, sagte Professor Bertram Häussler, Leiter des IGES-Instituts, bei einer Euroforum-Veranstaltung zu biosimilaren monoklonalen Antikörpern, die seit Kurzem erstmals für die Krebstherapie zur Verfügung stehen.
Ursächlich für die sehr langsame Marktdurchdringung sei, dass Ärzte und Fachgesellschaften einhellig die Auffassung vertreten, dass Biosimilars anders als chemische Generika die Originale nicht automatisch substituieren dürfen, wie Professor Diana Lüftner von der Deutschen Gesellschaft für Hämatologie und Onkologie und Professor Stephan Schmitz vom Berufsverband der Niedergelassenen Hämatologen und Onkologen betonten. Außerdem, so Häussler, ist der Preisvorteil von Biosimilars mit 10 bis 20 Prozent Ersparnis im Vergleich zum Original relativ geringer als bei chemischen Präparaten mit einer hohen Zahl von Anbietern und einem Preisabstand von bis zu 90 Prozent.
Ursächlich für Einschränkungen in der Substituierbarkeit von gentechnisch erzeugten Arzneimitteln ist einerseits der Produktionsprozess mit lebenden Mikroorganismen, der dazu führt, dass – anders als bei chemischen Arzneimitteln – die Struktur des Wirkstoffs nicht zu 100 Prozent identisch ist. Hinzu trat, wie Lüftner erklärte, ein Zulassungsprozedere für Biosimilars, von dem sich Ärzte erst durch erhebliche gedankliche Anstrengungen hätten überzeugen müssen.
Bei Generika gilt: Ist die Identität des Wirkstoffs nachgewiesen, dann ist die Gleichwertigkeit zum und Austauschbarkeit mit dem Original gegeben. Klinische Studien werden nicht gemacht und sind bei einer solchen Konstellation auch nicht nötig. Entscheidend beim Biosimilar ist die – in analytischen Verfahren nachgewiesene – weitgehende Ähnlichkeit der hochkomplexen Struktur des Wirkstoffs, ferner eine (prä-)klinische Studie für eine (Teil-)Indikation. Basierend auf diesen Erkenntnissen wird auf eine Similarität, nicht jedoch Identität extrapoliert. Das hat für den Einsatz von Biosimilars nach einhelliger Auffassung von Onkologen und Juristen Konsequenzen:
- In einer laufenden Therapie sollte, so Lüftner und Schmitz, ein Original nicht durch ein Biosimilar ausgetauscht werden.
- Aus haftungsrechtlichen Gründen, so der Medizinrechtler Professor Christian Dierks, muss der Patient bei der Verordnung sorgfältig aufgeklärt werden; ferner muss stets der Markenname des biotechnisch produzierten Arzneimittels auf dem Rezept angegeben und auch in der ärztlichen Dokumentation vermerkt werden. Nur so könne gewährleistet werden, dass die besonders strengen Pharmakovigilanz-Auflagen für Biosimilars funktionieren.