ATMP & Seltene Erkrankungen: Innovation in Forschung, Datenerhebung und Nutzenbewertung
ATMPs und seltene Erkrankungen: Potenzial und Herausforderungen
Immer mehr seltene Erkrankungen können mit zielgerichteten Medikamenten behandelt werden, und auch pathophysiologische Prozesse, die sich bislang einer Therapie entzogen haben, können zunehmend beeinflusst werden. Gen- und Zelltherapien spielen hierbei eine wichtige Rolle, da sie neue Zielstrukturen erschließen und zu verbesserten Nutzen-Risiko-Profilen führen können. Allerdings ergeben sich regelhaft Herausforderungen an die Nutzenbewertung und die Vergütung dieser innovativen Behandlungsregime: Therapien für kleine Patientengruppen oder zur Einmalanwendung werden mit Studienformaten zugelassen, die eine hinreichende Abschätzung der Wirksamkeit und Sicherheit durch regulatorische Behörden erlauben aber den Nachweis des Zusatznutzens aufgrund hoher methodischer Hürden erschweren. Gleichzeitig müssen Vergütungsmodelle neu gedacht werden, wenn Therapiekosten, die sich bei Dauertherapien auf viele Jahre verteilen, durch eine Einmalanwendung vorgezogen werden.
Veröffentlicht:
ATMPs und Orphan Drugs stellen für viele Patientinnen und Patienten eine bedeutsame und manchmal die einzige Therapieoption dar, sind beim Marktzugang aber mit spezifischen Herausforderungen konfrontiert.
© Gabriella88 / stock.adobe.com
Neue Chancen durch ATMPs und Orphan Drugs
Advanced Therapy Medicinal Products (ATMP, deutsch: Arzneimittel für neuartige Therapien) sind Gentherapeutika, somatische Zelltherapeutika oder biotechnologisch bearbeitete Gewebeprodukte.1 Oft handelt es sich dabei um Therapien für Patienten ohne zufriedenstellende Optionen mit hohem medizinischem Bedarf. Dies zeigt sich auch im hohen Anteil von ATMPs an den von der EMA als „Priority Medicines“ (PRIME) klassifizierten Arzneimitteln: mit Stand August 2025 waren von 96 Priority Medicines mehr als ein Drittel als ATMPs klassifiziert.2
Auch bei Betrachtung der seitens der EMA bewerteten ATMPs (Stand 2024 waren es 27) zeigt sich der hohe medizinische Bedarf, der durch diese Arzneimittelklasse adressiert wird: 52 Prozent hatten eine PRIME-Klassifizierung und 74 Prozent hatten Orphan Drug-Status.3
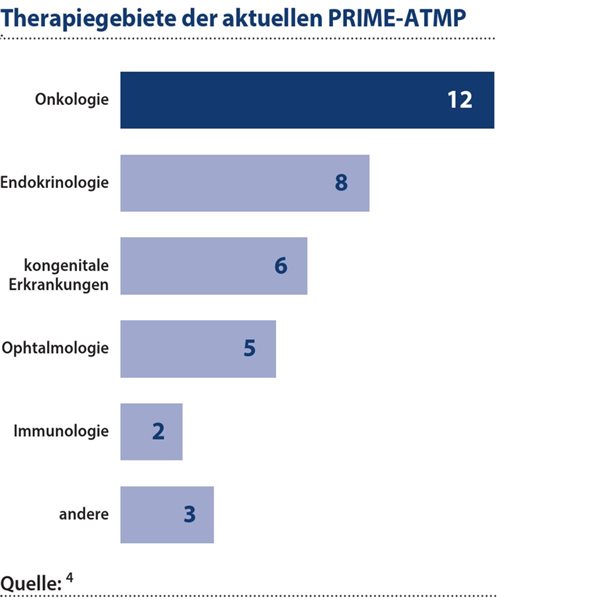
ATMPs werden durch CAR-Ts vor allem mit der Onkologie assoziiert, eine Analyse der PRIME-ATMPs zeigt allerdings eine breiter gefächerte Entwicklung auch in anderen Therapiegebieten. So entfielen von 36 Produkten 12 auf die Onkologie, 8 auf die Endokrinologie (darunter auch einige hereditäre Formen), 6 auf kongenitale Erkrankungen, 5 auf die Ophthalmologie, 2 auf die Immunologie und 3 auf andere Anwendungsgebiete.4
Häufig können über ATMPs pathophysiologische Prozesse beeinflusst werden, an denen mit klassischen „Small molecules“ oder Biologika kein Ansatzpunkt möglich ist. Ein Beispiel für den experimentellen ATMP-Einsatz außerhalb der Onkologie ist die Behandlung mit anti-CD19 CAR-T bei refraktärem Systemischem Lupus Erythematodes (SLE). SLE geht mit einem gut 5-fach erhöhten Sterberisiko bei inzidenten Patienten unter 45 Jahren einher.5
Der Einsatz von anti-CD19 CAR-T bei 5 Patienten unter 25 Jahren mit therapierefraktärem SLE mit Multiorganbeteiligung führte zu therapiefreier dauerhafter klinischer Remission bei allen 5 Patienten.6 Ausgehend von dieser hoch relevanten Proof-of-concept-Arbeit befinden sich inzwischen mehrere CAR-T in der klinischen Entwicklung für Autoimmunerkrankungen. Dennoch bleiben ATMPs im Großen und Ganzen bisher eine Randerscheinung im Markt für verschreibungspflichtige Arzneimittel: 2024 wurden in Deutschland 43 neue innovative Arzneimittel eingeführt, darunter war keine neue Gen- oder Zelltherapie.7
Herausforderungen für den Marktzugang von ATMPs und Orphan Drugs
ATMPs und Orphan Drugs stellen für viele Patientinnen und Patienten eine bedeutsame und manchmal die einzige Therapieoption dar. Unterschiedliche nationale Regelungen in den EU-Staaten und methodische Herausforderungen in der Nutzenbewertung haben Einfluss auf den Zugang von Patienten zu diesen wichtigen Therapieoptionen.
Ungleiche Bewertung innerhalb der EU
Bei den bereits zugelassenen ATMPs stellt eine wesentliche Herausforderung die regelhafte Überführung in die Versorgung dar. Eine Analyse von 18 bis Ende 2023 von der EMA zugelassenen ATMPs zeigt deutliche Unterschiede in der Verfügbarkeit in 23 von 27 analysierten EU-Mitgliedsstaaten. Die Verfügbarkeit von ATMPs war mit 89 Prozent am höchsten in Deutschland, gefolgt von Frankreich und Italien mit je 61 Prozent. Nur ein Drittel der untersuchten ATMPs war in mehr als einem Drittel der Mitgliedsstaaten verfügbar, bei drei dieser sechs ATMPs handelt es sich um CAR-Ts für hämatologische maligne Erkrankungen mit mehreren Indikationen.8
Neben Herausforderungen bei der häufig notwendigen Zertifizierung von Behandlungszentren, einer unzureichenden spezialmedizinischen Versorgung gerade in ländlichen Gegenden oder einer komplexen Supply Chain für CAR-T lohnt sich auch ein Blick auf die Nutzenbewertungsverfahren. Eine Analyse von HTA-Ergebnissen für ATMPs in Deutschland, Frankreich, Italien und den Niederlanden zeigt eine erhebliche Variabilität hinsichtlich des anerkannten Zusatznutzens (ZN). Während in Italien 5/5 bewertete Indikationen von Gentherapien einen bedeutsamen Zusatznutzen und Innovationsstatus (Anmerkung: höchster Zusatznutzenstatus) zugesprochen bekommen haben, wurde in Frankreich nur 1/8 Bewertungen ein erheblicher ZN attestiert (ASMRII) und in 6/8 Bewertungen ein moderater ZN abgeleitet. In Deutschland wurde seitens des Gemeinsamen Bundesausschusses (G-BA) in 6/8 Fällen ein nicht-quantifizierbarer ZN attestiert, ein durch den Orphan-Status gesetzlich gesicherter Mindestzusatznutzen.9 Eine mögliche Erklärung für die im Vergleich zu Italien geringere ZN-Einstufung in Deutschland liegt in den hohen Evidenzanforderungen, die besonderen Therapiesituationen oft nicht gerecht werden.

© ÄZ
Herausforderungen durch kleine Patientengruppen
Häufig zielen ATMPs auf kleine Patientengruppen: in 30 von 38 Verfahren stellt der G-BA weniger als 1.000 Patienten fest. Damit ergeben sich für ATMPs hinsichtlich des AMNOG-Verfahrens oft ähnliche Herausforderungen, wie sie im Allgemeinen bei Arzneimitteln für seltene Erkrankungen zu finden sind.10
© ÄZ
Die Entwicklung und Zulassung von Orphan Drugs hat sich seit der Einführung der EU-Verordnung über Arzneimittel für seltene Leiden vor gut 25 Jahren erheblich beschleunigt mit mehr als 3.000 vergebenen Orphan-Klassifizierungen und mehr als 260 zugelassenen Arzneimitteln für seltene Leiden.11 Diese für die betroffenen Patientinnen und Patienten erfreuliche Zunahme an Therapieoptionen kann sicherlich als europäische Erfolgsgeschichte gelten. Mitunter wird die steigende Zahl von Orphan Drugs mit dem Vorwurf des willentlichen „Salami-Slicings“ zur Erlangung eines OD-Status in Verbindung gebracht, also der artifiziellen Verkleinerung einer Patientenpopulation. Dabei ist dies aus regulatorischer Sicht nicht möglich. 12, 13
Im Gegenteil ergeben sich für Arzneimittel mit mehreren Indikationen häufiger Situationen, in denen der OD-Status aufgrund der Zulassung einer Indikation für die Teilpopulation eines größeren (Nicht-OD) Indikationsgebiets verloren geht und somit eine doppelte Dossierpflicht eintritt (für die Bestandsindikation jetzt unter Vollbewertungsmaßstäben und für die neue Indikation). Des Weiteren unterliegen bereits 80 Prozent der in Deutschland mit Orphan Drugs erzielten Umsätze einer „regulären“ Nutzenbewertung, die durch Überschreitung der 30 Millionen Euro-Umsatzgrenze ausgelöst wird (Analyse des vfa aus dem Jahr 2023).
Die Entwicklung von ATMPs und Orphan Drugs im Allgemeinen ist aufgrund der aufwändigeren Forschung und Entwicklung in seltenen Indikationen eine Herausforderung für Arzneimittelhersteller, kann sich aber im Erfolgsfall aufgrund des oftmals bedeutsamen therapeutischen Fortschritts und des raschen Eintritts in die Versorgung trotzdem lohnen. Der derzeitige Anteil von Orphans am weltweiten Umsatz mit verschreibungspflichtigen Arzneimitteln liegt bei etwa 20 Prozent. Dieser Umsatzanteil wird voraussichtlich auch bis zum Ende der Dekade stabil bleiben, wenn man den Orphan Drug-Anteil an den fortgeschrittenen klinischen Entwicklungsprogrammen und den prognostizierten weltweiten Umsätzen betrachtet.14
Herausforderungen durch Einmalgabe
Neben oft kleinen Patientengruppen stellt sich im HTA-Verfahren für viele ATMPs zusätzlich die Herausforderung die langfristige patientenrelevante Überlegenheit einer Einmalgabe gegenüber einer kontinuierlich verabreichten Vergleichstherapie zu belegen. Während regulatorische Anforderungen oft mit Nicht-Unterlegenheitsstudien mit kürzerer Laufzeit befriedigt werden können, verlangen die HTA-Anforderungen mitunter dezidierte zusätzliche randomisierte kontrollierte Studien mit langfristigen patientenrelevanten Wirksamkeitsendpunkten.

© ÄZ
Als Beispiel soll hier mit RGX-314 ein ATMP im Bereich der Ophthalmologie beschrieben werden: RGX-314 ist eine vektorbasierte Gentherapie, die mittels Injektion in das immunologisch abgrenzbare Augeninnere eingebracht wird und dort zur dauerhaften Expression eines gegen VEGF gerichteten Antikörpers führt. Hierdurch kann die regelhafte und breitflächig praktizierte intravitreale Injektion von anti-VEGFs vermieden und somit eine dauerhafte Verlangsamung der Visusverschlechterung bei Patienten mit feuchter Makuladegeneration erreicht werden.15
Das zulassungsrelevante Studienprogramm zu RGX-314 besteht aus zwei Phase-III-Studien (ATMOSPHERE, ASCENT) im Vergleich mit Ranibizumab, die in einem Nichtunterlegenheits-Design mit dem Endpunkt BCVA zu Woche 52 durchgeführt werden. In einer zusätzlich laufenden H2H-Studie (ACHIEVE) wird eine Einmalgabe von RGX-314 mit einer Ranibizumab-Gabe PRN (pro re nata) über bis zu fünf Jahren mit 187 Patienten pro Arm verglichen.
Die aufwändige H2H-Studie soll die Wahrscheinlichkeit eines Zusatznutzens erhöhen. Die erheblichen Unterschiede bei den Anwendungsschemata der experimentellen Gentherapie und dem zulassungskonformen Einsatz der Vergleichstherapie stellen eine Herausforderung für die Operationalisierung solcher Studien dar und sind trotz hoher Qualitätsstandards ein Einfallstor für im Rahmen der Nutzenbewertung geäußerte methodische Kritik zum Verzerrungspotenzial der betrachteten Endpunkte.
Ein Lösungsansatz: Empfehlungen der Nationalen Strategie für gen- und zellbasierte Therapien
Dass ATMPs und Orphan Drugs hoch relevant sind für schwer erkrankte Patientinnen und Patienten steht außer Frage. Um den frühen und breiten Zugang in Deutschland auch zukünftig sicherzustellen, wurden konkrete Handlungsempfehlungen bereits in der nationalen Strategie für gen- und zellbasierte Therapien benannt, die hier abschließend zusammengefasst werden.16
Berücksichtigung der bestverfügbaren Evidenz im Rahmen der Nutzenbewertung: Eine Anpassung rechtlicher Rahmenbedingungen und Ausführungsverordnungen (AM-NutzenV, G-BA-Verfahrensordnung) ist notwendig. Es soll nicht nur Evidenz der höchsten Evidenzstufe gefordert werden, sondern die Bewertung soll auf Basis der Nachweise der bestverfügbaren Evidenzstufe erfolgen, sodass die eingereichten Studien berücksichtigt werden (müssen).
Anpassung der Kriterien für die Berücksichtigung versorgungsnaher Daten bei der Nutzenbewertung: Die Anforderungen an eine Anwendungsbegleitende Datenerhebung (AbD) sind unverhältnismäßig hoch. Die Angemessenheit und Realisierbarkeit einer AbD müssen daher bereits im ersten Verfahrensabschnitt und noch vor Beauflagung unter Einbindung der Fachkreise und des betroffenen Unternehmens beurteilt werden.
Konkretisierung der nutzenbasierten Preisbildung: Die im Rahmen des GKV-Finanzstabilisierungsgesetzes (GKV-FinStG) eingeführten Leitplanken sollen entfallen und die Nutzenkategorie „nicht quantifizierbar“ soll damit auf ihre ursprüngliche Bedeutung zurückgeführt werden (nicht kleiner als gering).
Verstärkte Nutzung von erfolgsabhängigen Erstattungsmodellen (Pay-for-Performance): Auch wenn Pay-for-Performance-Verträge nach Paragraf 130b SGB V bereits heute geschlossen werden können, muss zur Schaffung von Anreizen durch verschiedene Vergütungsmodalitäten, insbesondere Einmalzahlungen gegenüber Ratenzahlungen, die derzeitige Struktur des Risikopools im Morbi-RSA an diese neuen Modelle angepasst werden. Außerdem muss die Möglichkeit des Trackings von Patientinnen und Patienten gemäß dem Sondergutachten des Bundesamts für Soziale Sicherung geschaffen werden.
Vereinheitlichung und Kostendeckung der Vergütung: Die Vergütung der (oft komplexen und teuren) Diagnostik und die Erstattung von Qualitätssicherung/Aufwänden in den Behandlungseinrichtungen ist angeraten.
Standardisierung der Erfassung und Dokumentation von Anwendungsdaten: Ein nationales GCT-Register soll aufgebaut und angebunden werden für die standardisierte und digitalisierte Nachverfolgung von Anwendung, Langzeitsicherheit und Wirksamkeit, einheitliche Prüfprozesse zur Ermittlung der Evidenz für nicht-zulassungsfähige GCT. Es wird der Aufbau einer altruistischen Betreiberstruktur vorgeschlagen, wobei die Kosten von Staat und gegebenenfalls Herstellern getragen werden sollen.

© Dr. Henning Kleine
© privat
Dr. Henning Kleine
ist Director Market Access und Teil der Geschäftsführung bei AbbVie Deutschland GmbH & Co. KG. Als promovierter Molekularbiologe hat er viele Jahre mit steigender Verantwortung bei AbbVie im Bereich Medical Affairs gearbeitet, zuletzt als Vice President für Europa. Er bringt vielfältige Expertise bei der Forschung und Entwicklung sowie Kommerzialisierung von innovativen Arzneimitteln mit.
Literatur
1 Paul Ehrlich Institut, https://www.pei.de/DE/arzneimittel/atmp/atmp-node.html letzter Zugriff 25. September 2025.
2 https://www.ema.europa.eu/en/human-regulatory-overview/research-development/prime-priority-medicines (Zugriff: 13.8.2025).
3 Alaburde S, Ivaska J, Kaspute G and Ivaskiene T (2025) Front. Med. 12:1623689. doi: 10.3389/fmed.2025.1623689
4 https://www.ema.europa.eu/en/human-regulatory-overview/research-development/prime-priority-medicines
5 Zen et al. (2023) Eur J Intern Med 112: 45-51.
6 Mackensen et al. (2022) Nat Med 28: 2124-2132.
7 https://www.vfa.de/de/arzneimittel-forschung/neueinfuehrungen/innovationsbilanz-2024 (Zugriff: 13.8.2025).
8 Cechová, Z., Kubátová, J., Bártová, A. et al. (2025) Ther Innov Regul Sci 59, 728-736.
9 Gozzo L, Romano GL, Romano F, Brancati S, Longo L, Vitale DC and Drago F (2021) Health Technology Assessment of Advanced Therapy Medicinal Products: Comparison Among 3 European Countries. Front. Pharmacol. 12:755052. doi: 10.3389/fphar.2021.755052.
10 https://www.amnog-monitor.com/de/ (Zugriff: 13.8.2025).
11 https://www.ema.europa.eu/en/human-regulatory-overview/orphan-designation-overview#infosheet-orphan-medicines-in-the-eu-74571 (Zugriff: 13.8.2025).
12 EMA, Guideline on the format and content of applications for designation as orphan medicinal products and on the transfer of designations from one sponsor to another, 27.03.2014; EMA/COMP/15893/2009, ENTR/6283/00 Rev 4, online abrufbar unter https://health.ec.europa.eu/document/download/97cd987c-9cfb-4226-8a34-d8250af59833_en (Zugriff am 24.Juni 2025).
13 Communication from the Commission on Regulation (EC) No 141/2000 of the European Parliament and of the Council on orphan medicinal products; Official Journal C 178 , 29/07/2003 P. 0002 – 0008; online abrufbar unter https://eur-lex.europa.eu/legal-content/EN/TXT/HTML/?uri=CELEX:52003XC0729(01) (Zugriff 13.08.2025).
14 https://www.evaluate.com/thought-leadership/orphan-drugs-2025-report/ (Zugriff: 13.8.2025).
15 Ding et al. (2019) J Clin Invest. 129(11):4901-4911.
16 https://www.bihealth.org/fileadmin/GZT/NEU_250619_Strategiepapier_DE.pdf (Zugriff: 13.8.2025).




