EU-Pharma-Regulierung – Impulse für Deutschland
Trends der Arzneimittelzulassung in Deutschland/EU versus FDA: Fallbeispiele
Die Europäische Arzneimittel-Agentur (EMA) und die US-amerikanische Food and Drug Administration (FDA) treffen in mehr als 90 Prozent der Fälle übereinstimmende Entscheidungen zur Marktzulassung neuer Arzneimittel.1 Die hohe Übereinstimmung ist das Ergebnis intensivierter Zusammenarbeit beider Behörden seit 2003, die die Angleichung der Zulassungsentscheidungen gestärkt hat, obwohl beide Behörden ihre Anträge unabhängig prüfen und unterschiedlichen Systemen unterliegen, die Unterschiede in der Bewertungspraxis und -dauer bedingen können.2 Die föderal konzipierte European Medicines Agency (EMA) und die stärker zentral ausgerichtete US-amerikanische Food and Drug Administration (FDA) weisen wesentliche strukturelle und prozessuale Differenzen auf. Die Dauer der EMA-Zulassungsverfahren übersteigt im Durchschnitt die Dauer der FDA-Verfahren. Die Einreichung der Zulassungsunterlagen und damit der Beginn des Verfahrens erfolgt in den USA nahezu regelhaft früher als in Europa.3 Anhand von drei Fallbeispielen wird ein Trend zu i) enger gefassten Indikationsstellungen (Lecanemab), ii) geringerer Akzeptanz von Surrogatparametern (Pegcetacoplan) und iii) größerer Zurückhaltung bei der Akzeptanz einarmiger Studiendesigns (Mobocertinib) in Europa beschrieben. Um diesem Trend entgegenzuwirken, wurden auf nationaler und europäischer Ebene eine Vielzahl an Maßnahmen und Aktivitäten initiiert, die die Stärkung des Forschungs- und Pharmastandortes Deutschland und Europa zum Ziel haben.
Veröffentlicht:
© Ting Shen / Xinhua News Agency / picture alliance
EMA versus FDA – strukturelle und prozessuale Charakteristika
Sowohl im europäischen zentralen Zulassungsprozess sowie im Verfahren durch die FDA werden folgende Parameter geprüft:
Qualität
Wirksamkeit (Efficacy)
Sicherheit (Safety).
Beide verfolgen den Ansatz der evidenzbasierten Bewertung klinischer Studien. Der Fokus der EMA liegt auf einer „positiven Nutzen-Risiko-Bilanz“, die auch bei Unsicherheiten diskutierbar ist, aber generell ein vollständiges Datenpaket aus randomisierten klinischen Studien bevorzugt. Die FDA zeigt einen Fokus auf „substanzielle Wirksamkeit“ und Sicherheit auf Basis klarer Studiendaten, akzeptiert aber auch Daten aus z. B. einarmigen Studiendesigns, die dann komplettiert werden müssen. Strukturell und prozessual zeigen sich erhebliche Unterschiede zwischen der US-amerikanischen FDA und der EMA.
Wichtige strukturelle Charakteristika beider Behörden sind in Tabelle 1 gegenübergestellt. Ebenso wie bei der EU HTA Regulation (EUHTAR)4 reflektiert dabei der europäische Zulassungsprozess die föderale, dezentrale Struktur der europäischen Union (EU) unter Anerkennung der Diversität der Mitgliedstaaten (z. B. hinsichtlich Gesundheitssystemen, Sprachen, Expertisen), wohingegen die FDA eine straff zentral organisierte Behörde darstellt. Zuständigkeit, Mitarbeiterstruktur, budgetäre Rahmenbedingungen etc. unterscheiden sich erheblich zwischen FDA und EMA.
Hohe Transparenz der Arbeitsabläufe in der EMA
Auch prozessual zeigen sich erhebliche Unterschiede zwischen den Behörden (Tabelle 2). Die Einbindung der FDA erfolgt regelhaft sehr frühzeitig ab der Genehmigung von klinischen Studien. Ebenso sind die seitens der Industrie verfügbaren klinischen und präklinischen Daten gegenüber der FDA transparent. Dagegen wird die EMA häufig erst später und ggf. nur mit partieller Datentransparenz in die Entwicklungsprogramme einbezogen.
Umgekehrt besteht jedoch eine hohe Transparenz hinsichtlich der Arbeitsresultate der EMA, wohingegen die FDA jeweils nur eine zusammenfassende Darstellung zur jeweiligen Zulassung veröffentlicht.
Die Zulassungszeiten unterscheiden sich zum Teil erheblich zwischen FDA und EMA; so betrug im Jahr 2023 der Median für die Zulassungszeit (d. h. Tage zwischen Einreichung des Zulassungsantrages bis zur Zulassung) einer neuen aktiven Substanz (NAS) 453 Tage in der EU und 333 Tage in den USA. Dabei ist zu beachten, dass die wissenschaftliche Beurteilung und auch die anschließende Zulassungsempfehlung in Europa seitens der EMA erfolgt, die eigentliche Zulassungsentscheidung obliegt im Anschluss jedoch der Europäischen Kommission; in den USA erfolgt die Zulassung dagegen zeitsynchron beim Abschluss der wissenschaftlichen Beurteilung. Die mediane Zeit bis zum Abschluss der wissenschaftlichen Beurteilung beträgt seitens EMA (378 Tage) und FDA (333 Tage).5 Gemeinsamkeiten bestehen in den Anreizsystemen von EMA und FDA für einen früheren Markteintritt. Beide Behörden haben ähnlich attraktive Optionen eingeführt, die eine frühere Markteinführung versprechen (Orphan Designation und Breakthrough Therapy Designation, PRIME und Priority Review, Conditional Approval und Accelerated Approval).
Fehlende Sicherheit bei Planbarkeit der Zulassungsverfahren
Sowohl FDA als auch EMA sind erheblichen internen und externen Herausforderungen ausgesetzt. Die Auswirkungen der aktuellen Veränderung der politischen Rahmenbedingungen in den USA auf Arbeitsweise und Funktionalität der FDA sind derzeit noch nicht vollumfänglich absehbar. Die Zielvorgaben für die EMA sind die Einhaltung höchster wissenschaftlicher und regulatorischer Standards im Interesse der Patienten, die Unterstützung innovativer Therapieansätze, umfängliche Transparenz und die Begrenzung der Review Zeit auf 210 Tage.
Zentrale Herausforderung bei der Umsetzung dieser ambitiösen Ziele sind die ständige Zunahme der Arbeitsanforderungen bei limitierten Ressourcen. Die vorhandene Expertise und auch die Anzahl der Experten in den Zulassungsbehörden sind begrenzt. Die zunehmend strikte Auslegung von ‚Conflict of Interest‘-Vorgaben begrenzt die Nutzbarkeit existierender Expertise aus dem akademischen Umfeld in den Zulassungsverfahren zusätzlich.
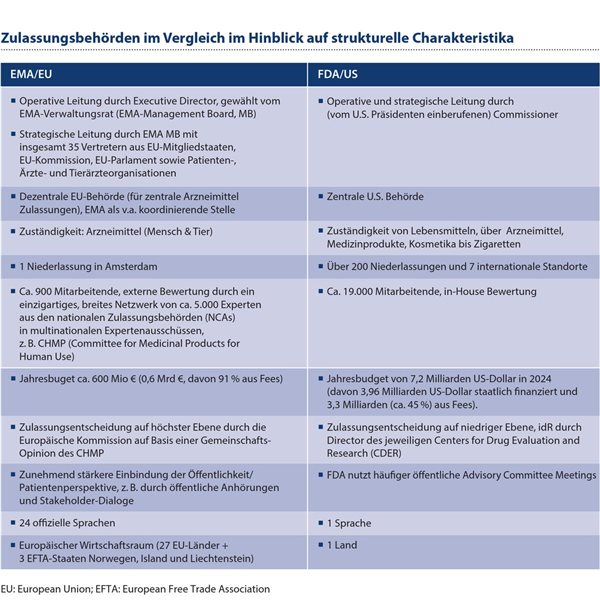
Tabelle 1: Die Zulassungsbehörden EMA und FDA unterscheiden sich in vielen strukturellen Charakteristika: In der EMA spiegelt sich die dezentrale Struktur der EU, die FDA ist eine straff zentral organisierte Behörde.
© BfArM
Anhand von drei Fallbeispielen werden im Folgenden beispielhaft Unterschiede in Zulassungsverfahren von EMA und FDA einander gegenübergestellt, ohne dass dies grundsätzlich generalisierbar ist.
Fallbeispiel 1: Lecanemab
Lecanemab ist ein humanisierter monoklonaler Immunglobulin-Gamma-1 Antikörper, der die Ablagerung von Beta-Amyloid bei Patienten mit Alzheimer Erkrankung verhindert. Die Bewertungsgrundlage sind die Phase 2 Studie 201 sowie die Phase 3-Studien ‚Clarity‘. In Studie 201 wurden 854 Patienten eingeschlossen. Der primäre Studienendpunkt bzgl. des Alzheimer’s Disease Composite Score (ADCOMS) nach zwölf Monaten wurde nicht erreicht, jedoch zeigte sich eine Minderung der Amyloid-Ablagerungen im Gehirn und entsprechende Trends bei der Minderung der krankheitsbedingten klinischen Verschlechterung.7 Die randomisierte, kontrollierte, doppelblinde Phase 3-Studie ‚Clarity‘ zeigte an bei 1795 Patienten eine moderat ausgeprägte Minderung der Verschlechterung von Kognition und Funktion, aber ergab eine Zunahme relevanter Nebenwirkungen.8

Tabelle 2: Die beiden Zulassungsbehörden weisen hinsichtlich ihrer prozessualen Charakteristika große Unterschiede auf: Die Einbindung der FDA in Entwicklungsprogramme erfolgt regelhaft sehr frühzeitig, bei der EMA eher spät.
© BfArM
Die europäische Zulassung bezieht sich im Gegensatz zu der FDA nur auf eine eingeschränkte Patientenpopulation, die Apolipoprotein E 4 (APOE4) nicht exprimiert bzw. heterozygot ist. Als Hintergrund dieser Einschränkung werden die beobachteten Nebenwirkungen und nicht die Wirksamkeit angeführt:
Im Rahmen der Durchführung der Re-examination der EMA und des dabei erfolgten Wechsels von der negativen zur positiven Einschätzung des CHMP9 betrachteten Rapporteur und Co-Rapporteur die Wirksamkeit für Lecanemab für die gesamte Population als ausreichend gezeigt. Der primäre Studienendpunkt wurde erreicht (-0.45; 95% CI: -‘.67; 0.23; p<0.001). Progressor-Analysen und ‚Time-saved‘-Analysen bestätigten diese Vorteile in der Gesamtpopulation. Zudem zeigten bei Patienten, die APOE4 nicht exprimieren bzw. heterozygot sind Verbesserungen in weiteren klinischen Parametern:
Clinical Dementia Rating (Sum of Boxes); CDR-SB:
-0.58 (95% CI: -0.81, -0.35)
Alzheimer’s Disease Assessment Scale (Cognitive Subscale); ADAS-Cog14:
-1.63 (95% CI: -2.56, -0.71)
Activities of Daily Living for Mild Cognitive Impairment; ADCS-MCI-ADL:
2.23 (95% CI: 1.34, 3.13)
Bei der Prüfung der aktuellen Sicherheitsdaten zeigten sich jedoch bei verschiedenen Sicherheitsendpunkten wie ARIA (Amyloid-related imaging abnormalities) bzw. intrazerebrale Blutungen (ICH) stärkere Signale bei den APOE4 homozygoten Patienten, weshalb diese Patienten von der Zulassung ausgeschlossen wurden. In den USA wurde nur ein entsprechender Warnhinweis in den Zulassungstext eingefügt.10
Fallbeispiel 2: Pegcetacoplan
Pegcetacoplan ist ein C3 Komplement-Inhibitor welcher das Absterben der Netzhautzellen bei Geographischer Atrophie, GA, (d. h. irreversible und fortschreitende Ausdünnung und Verlust des retinalen Pigmentepithels) infolge altersbedingter Maculadegeneration, AMD, verlangsamt.
Bewertungsgrundlage sind die beiden doppelblind, randomisierten und Sham-kontrollierten Studien OAKS (n=637 Teilnehmer) und DERBY (n = 621 Teilnehmer).11 Der primäre Studienendpunkt in beiden Studien erfasste die Gesamtfläche der GA. Als sekundäre Endpunkte wurden verschiedene Parameter zur Messung der Sehfunktion erhoben. Im Ergebnis zeigte sich nach 24 Monaten, dass eine alle zwei Monate verabreichte intravitreale Injektion mit Pegcetacoplan das Wachstum der GA-Läsionen um 22 Prozent (OAKS) bzw. 19 Prozent (DERBY) verlangsamen kann.

Tabelle 3: Zeitverlaufs der beiden Zulassungsverfahren zu Lecanemab – der Zeitbedarf liegt jeweils bei ca. zwei Jahren, allerdings beginnt der EMA-Prozess aufgrund der späteren Übermittlung des Zulassungsantrags deutlich zeitverzögert.
© BfArM
Auch der Blick über den Vergleich von EMA/FDA hinaus bestätigt die besonderen Herausforderungen dieses Fallbeispiels: die englische ‚Medicines & Healthcare Products Regulatory Agency‘ (MHRA) kam im November 2024 zu einer negativen Einschätzung. Die australische Therapeutic Goods Administration (TGA) erteilte im Januar 2024 eine Zulassung mit beschränkter Indikation.
Zu erwähnen ist in diesem Zusammenhang, dass das Fast Track Verfahren in den USA insgesamt ca. 3,5 Jahre bis zur (positiven) Entscheidungsfindung in Anspruch genommen hat; der Zeitrahmen für das sehr aufwändige europäische Verfahren betrug dagegen nur zwei Jahre bis zur (negativen) Entscheidung des CHMP. Wiederum wurden die Unterlagen für das europäische Zulassungsverfahren erst mit Zeitverzug nach Beginn des FDA-Verfahrens eingereicht.
Fallbeispiel 3: Mobocertinib
Mobocertinib ist ein Tyrosin Kinase Inhibitor, der den Epidermal Growth Factor Rezeptor (EGFR) selektiv inhibiert und für das EGFR-Exon 20 positive nicht klein-zellige Lungenkarzinom in der späteren Therapielinie entwickelt wurde. In den USA erfolgte im September 2021 eine beschleunigte Zulassung, auf Empfehlung der FDA erfolgte im März 2024 dann die Marktrücknahme seitens des pharmazeutischen Unternehmers, nachdem die geforderte Phase III Studie den klinischen Nutzen nicht belegen konnte. In Europa war Mobocertinib zu keinem Zeitpunkt zugelassen. Der Antrag für eine bedingte Marktzulassung (CMA) wurde im Juli 2022 durch das Unternehmen zurückgezogen.
Hintergrund dieses Verfahrens bildete die post-hoc definierte Subpopulation der einarmigen Studie AP32788-15-101, die eine Ansprechrate (ORR) von 28 Prozent zeigte.12 Die randomisierte Phase 3-Studie ‚Exclaim-2‘ in der Erstlinientherapie wurde dann jedoch nach einer präspezifizierten Interimsanalyse im Juli 2023 aufgrund der fehlenden Überlegenheit gegen die Platin-basierte Vergleichstherapie beendet.13

Tabelle 4: Wesentliche Unterschiede im Verfahren zwischen der FDA und der EMA bezogen sich im Zulassungsverfahren für Pegcetacoplan auf die Akzeptanz der Studienendpunkte.
© BfArM
Vor diesem Hintergrund gewinnt die Frage an Bedeutung, wie Deutschland als führender Standort innerhalb der europäischen Arzneimittelregulierung dazu beitragen kann, sowohl regulatorische Exzellenz als auch eine innovationsfreundliche Umgebung sicherzustellen. Die nachfolgenden Maßnahmen zeigen auf, wie das BfArM, auch in enger Abstimmung und Kooperation mit dem Paul-Ehrlich-Institut (PEI) gezielt auf nationaler Ebene – im Zusammenspiel mit europäischen Initiativen – Impulse zur Stärkung des Pharmastandorts Deutschland setzt.
Maßnahmen zur Stärkung des Pharmastandorts Deutschland
Die Stärkung des Pharmastandorts Deutschland und Europa im internationalen Umfeld ist neben der Versorgung der Bevölkerung mit qualitativ hochwertigen und sicheren Arzneimitteln ein zentrales Anliegen des BfArM. In der entwickelten Pharmastrategie und aktuell im Medizinforschungsgesetz ist ein ganzes Paket von ineinandergreifenden Maßnahmen verankert, die diesem Ziel dienen und an dessen Umsetzung und Implementierung das BfArM schwerpunktmäßig beteiligt ist. Beispielhaft können hier genannt werden:
Prozessoptimierung, Beschleunigung und Entbürokratisierung ist das gemeinsame Ziel beider Bundesoberbehörden, BfArM und PEI. Zur Umsetzung dieser Zielvorgabe wurden bereits eine Reihe an Maßnahmen ergriffen:
Das BfArM hat als ‚Single Entry Point‘ die Koordinierung und das Verfahrensmanagement für Zulassungsverfahren und Anträgen zur klinischen Prüfung (inklusive Ethikvotum und Strahlenschutz) für alle Arzneimittel übernommen.
Auch bei wissenschaftlichen Beratungen wurde das ‚Single Gate‘ Verfahren implementiert. Die Antragsformulare wurden digitalisiert, die Prozesse angepasst und schnellere Bearbeitungszeiten realisiert. Die Nutzung der Fachexpertise beider Behörden wurde dabei vollumfänglich sichergestellt.
Die Etablierung einer spezialisierten Ethikkommission nach Paragraf 41c Arzneimittelgesetz (AMG):14 Ziel dieser Initiative ist die Bündelung der Fachkompetenz für besonders dringliche und komplexe Zulassungsverfahren. In den Zuständigkeitsbereich der Ethikkommission fallen ab 01.07.2025 unter anderem Studien, die in der Notfall-Einsatzgruppe der EMA behandelt werden, komplexe Masterprotokoll-Studien, First-in-Human Studien und ATMP-Studien. Berufen wurden die mehr als 100 Mitglieder über eine Ausschreibung des Bundesministeriums für Gesundheit, die Geschäftsstelle ist beim BfArM angesiedelt.
Stärkung der Digitalisierung im Gesundheitswesen: zahlreiche gesetzliche und untergesetzliche Initiativen (z. B.: Digitalisierungsgesetz, Gesundheitsdatennutzungsgesetz, Verordnung über einen europäischen Gesundheitsdatenraum, European Medicines Agencies Network Strategy to 2028 etc) zielen auf eine Förderung der Digitalisierung im Gesundheitswesen und der Zulassungsprozesse ab. Ebenso wie bei der Unterstützung der Digitalen Gesundheitsanwendungen (DIGA15) nimmt das BfArM eine Vorreiterrolle bei der Umsetzung dieser Vorhaben ein.
Klinische Evidenz 2030: Der Paradigmenwandel in der klinischen Grundlagenforschung hin zu immer stärker zielgerichteten Arzneimitteln hat auch weitreichende Auswirkungen auf die Erhebung und Interpretation klinischer Evidenz. Eine Vision zur ‚Clinical Evidence 2030‘ wurde kürzlich seitens regulatorischer Experten im europäischen Netzwerk entwickelt. Danach wird vor allem die Patientenperspektive viel stärker Ausgangs- und Zielpunkt klinischer Forschung darstellen. Zunehmend effektive und aussagekräftige Studiendesigns richten sich an den spezifischen Forschungsfragestellungen aus; die Entwicklung von Real-World Evidenz (RWE) wird weitergefördert; gemeinsam mit klinischen Studien wird so die externe wie die interne Validität der Studienprogramme gesteigert und hochtransparente Verfahren und Prozesse steigern die Qualität der Zusammenarbeit und das gegenseitige Vertrauen.16
Zeitverlust zwischen CHMP-Empfehlung und Zulassung durch Kommission
Zusammenfassend ist hervorzuheben, dass gemäß der föderalen Struktur der Europäischen Union wesentliche strukturelle Differenzen zwischen der EMA und der stärker zentral organisierten FDA bestehen. Insgesamt übersteigt die Dauer der EMA-Zulassungsverfahren die der FDA-Verfahren vor allem aufgrund des formalen „clock stop“ und des mehrstufigen Entscheidungsprozesses mit Zeitverlust zwischen CHMP-Empfehlung und Zulassung seitens der EU-Kommission. Zudem erfolgt die Einreichung der Zulassungsunterlagen und damit der Beginn des Verfahrens in den USA nahezu regelhaft früher als in Europa, so dass die europäische Zulassungsentscheidung häufig auf einer breiteren Datengrundlage gefällt werden kann.
Die eingeführten Fallbeispiele zeigen exemplarisch den Trend zu i) enger gefassten Indikationsstellungen (Lecanemab), ii) geringerer Akzeptanz von Surrogatparametern (Pegcetacoplan) und iii) größerer Zurückhaltung bei einarmigen Studiendesigns (Mobocertinib) in Europa. Auf nationaler und europäischer Ebene wurde eine Vielzahl an Maßnahmen und Aktivitäten initiiert (neue EU-Gesetzgebung, Medizinforschungsgesetz), die neben einer qualitativ hochwertigen und sicheren Arzneimittelversorgung die Stärkung des Forschungs- und Pharmastandortes Deutschland voranbringen wollen. Das BfArM ist hierbei, zusammen mit dem PEI, mit großem Engagement und in einer führenden Rolle engagiert.

© BfArM/Jörn Wolter
Literatur
1 Kashoki M, Hanaizi Z, Yordanova S, Veselý R, Bouygues C, Llinares J, Kweder SL. A Comparison of EMA and FDA Decisions for New Drug Marketing Applications 2014-2016: Concordance, Discordance, and Why. Clin Pharmacol Ther. 2020 Jan;107(1):195-202. doi: 10.1002/cpt.1565. Epub 2019 Aug 14. PMID: 31306483; PMCID: PMC6977394 [Zugriff: 23.6.2025]
2 Europäische Arzneimittel-Agentur (EMA): EMA-FDA analysis shows high degree of alignment in marketing application decisions between EU and US, 2. September 2020, online unter: https://www.ema.europa.eu/en/news/ema-fda-analysis-shows-high-degree-alignment-marketing-application-decisions-between-eu-and-us [Zugriff: 18.6.2025]
3 Lythgoe MP, Desai A, Gyawali B, et al. Cancer Therapy Approval Timings, Review Speed, and Publication of Pivotal Registration Trials in the US and Europe, 2010-2019. JAMA Netw Open. 2022; 5(6):e2216183.doi:10.1001/jamanetworkopen.2022.16183 [Zugriff: 23.6.2025]
4 Regulation (EU) 2021/2282 of the European Parliament and of the Council of 15 December 2021 on health technology assessment and amending Directive 2011/24/EU. https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32021R2282 [Zugriff: 25.4.2025]
5 Centre for Innovation in Regulatory Science (2024) R&D Briefing 93: New drug approvals in six major authorities 2014–2023: Changing regulatory landscape and facilitated regulatory pathways. Centre for Innovation in Regulatory Science (CIRS), London, UK. https://cirsci.org/publications/cirs-rd-briefing-93-new-drug-approvals-by-six-major-authorities-2014-2023/ [Zugriff: 25.4.2025]
6 BfArM; 2025. Data on file
7 Swanson CJ, Zhang Y, Dhadda S et al. A randomized, double-blind, phase 2b proof-of-concept clinical trial in early Alzheimer’s disease with lecanemab, an anti-Ab protofibril antibody. Alzheimers Res Ther 2021; 13(1): 80
8 van Dyck CH, Swanson CJ, Bateman RJ et al. Lecanemab in Early Alzheimer’s Disease. NEJM; 2023; 388: 9-21
9 https://www.ema.europa.eu/en/documents/smop-initial/chmp-summary-positive-opinion-leqembi_en.pdf [Zugriff 24.4.2025]
10 https://www.accessdata.fda.gov/drugsatfda_docs/label/2024/217171s002lbl.pdf [Zugriff 24.4.2025]
11 Heier JS, Lad EM, Holz FG et al. Pegcetacoplan for the treatment of geographic atrophy secondary to age-related macular degeneration (OAKS and DERBY): two multicentre, randomised, double-masked, sham-controlled, phase 3 trials. Lancet 2023; 402: 1434-1448
12 Duke ES, Stapleford L, Drezner N et al. FDA Approval Summary: Mobocertinib for Metastatic Non-Small Cell Lung Cancer with EGFR Exon 20 Insertion Mutations. Clin Cancer Res 2023; 29(3): 508-512
13 Jänne PA, Wang BC, Cho BC et al. First-Line Mobocertinib versus Platinum-Based Chemotherapy in Patients with EGFR Exon 20 Insertion-Positive Metastatic Non-Small Cell Lung Cancer in the Phase III Exlaim – 2 Trial. JCA, 2025: https://ascopubs.org/doi/pdf/10.1200/JCO-24-01269 [Zugriff 24.4.2025]
14 https://go.sn.pub/lul8cj [Zugriff 24.4.2025]
15 https://diga.bfarm.de/de [Zugriff 24.4.2025]
16 Arlett P, Umuhire D, Verpillat P et al. Clinical Evidence 2030. Clin Pharmacol Ther: 2025, 117 (4). https://doi.org/10.1002/cpt.3596 [Zugriff 24.4.2025]