EU-Pharma-Regulierung: Impulse für Deutschland
Arzneimittelversorgung in der EU: Status und Ausblick aus Sicht der GKV
Die Reform der europäischen Arzneimittelgesetze ist im vollen Gange. Mit ihr soll auch aktuellen europäischen Herausforderungen begegnet werden. Neben der sogenannten „Pharma Legislation“ wurde bereits der erste Verordnungsentwurf des „Critical Medicines Act“ von der Europäischen Kommission vorgelegt. Dieses Gesetz soll sicherstellen, dass in der EU zugelassene Arzneimittel auch tatsächlich für die Versorgung in der EU zur Verfügung stehen. Aus Sicht der gesetzlichen Krankenversicherung finden sich viele für die deutsche Arzneimittelversorgung relevante Aspekte in den laufenden, europäischen Gesetzgebungsverfahren.
Veröffentlicht:
© Reuhl / Fotostand / picture alliance
Die wichtigsten Aspekte der Pharma-Legislation Reform des Unterlagenschutzes und die Folgen für die GKV-Finanzen
Eine besonders wichtige Regelung, die mit dem Gesetzespaket reformiert werden soll, ist der Zeitrahmen zum Unterlagenschutz für neu auf den Markt gebrachte Arzneimittel. Die bisherige Regelung sieht einen maximalen kombinierten Schutz durch Unterlagenschutz und Marktexklusivität von elf Jahren vor. Nach den Plänen der EU-Kommission würde der Zeitraum auf maximal zwölf Jahre erhöht werden, während die Pläne des EU-Parlaments einen Zeitraum von elfeinhalb Jahren vorsehen.1 Beide Reformvorschläge eint, dass sie den Schutzzeitraum in Abhängigkeit bestimmter Kriterien stärker modulieren möchten (siehe Abbildung 1).
Durch eine Verlängerung von Unterlagenschutz oder Marktexklusivität verzögert sich der Eintritt des Generikawettbewerbs. Gemäß den Berechnungen der Deutschen Sozialversicherung Europavertretung (DSV) bedeutet jedes Jahr zusätzlicher regulatorischer Schutz Mehrausgaben für die GKV in Höhe von mehr als einer Milliarde Euro. Betrachtet man den ganzen europäischen Markt in demselben Zeitraum, betragen die zusätzlichen Kosten mehr als drei Milliarden Euro.2 Diese Zahlen machen deutlich, welchen erheblichen Einfluss diese Regelung nicht nur auf die Finanzierbarkeit des Gesundheitssystems in Deutschland, sondern auch für die Gesundheitssysteme in den anderen EU-Mitgliedsstaaten haben kann (siehe Abbildung 2).
Erweiterung der „Bolar Exemption“
Regulatorische Schutzrechte und der Patentschutz gewähren Unternehmen ein zeitlich befristetes Monopol. Dies soll den Unternehmen die Möglichkeit zu geben, ihre Aufwendungen für Forschung und Entwicklung zu refinanzieren. Sind die Schutzzeiträume aber einmal abgelaufen, soll ein möglichst ungehinderter marktwirtschaftlicher Wettbewerb rasch einsetzen, wodurch die Preise sinken und Mittel frei werden, die für weitere Innovationen eingesetzt werden können.
Ziel der sogenannten „Bolar Exemption“ ist es, dass dieser generische Wettbewerb bereits an Tag 1 nach Ablauf jeglicher Schutzfristen beginnen kann. Pharmazeutische Unternehmen von Generika-Arzneimitteln sowie Biosimilars sollen dabei die Möglichkeit bekommen, Arzneimittelstudien mit dem Referenzarzneimittel durchzuführen. Diese Studien sind oftmals für eine Zulassung des generischen Arzneimittels notwendig. Die Position des EU-Parlaments sieht eine weite Auslegung und eine rechtssichere Klarstellung vor. Diese Studien für eine Zulassungs- und Erstattungsentscheidung sowie zur HTA-Durchführung sollen noch während des laufenden Patentschutzes des Referenzarzneimittels möglich sein. Hiervon umfasst sind auch alle damit verbundenen Aktivitäten. Zudem wird mit dem Vorschlag des EU-Parlaments mit einem separaten Artikel klargestellt, dass der Patentschutz keinen Einfluss auf Entscheidungen zu Zulassung, HTA und Erstattung haben darf (Verbot des sog. „Patent-Linkage“). Durch diese Regelung könnte es zu einem früheren Preiswettbewerb kommen. Dieser Preiswettbewerb ist für die Vielfalt und Finanzierbarkeit der deutschen Arzneimittel-Versorgung besonders wichtig.
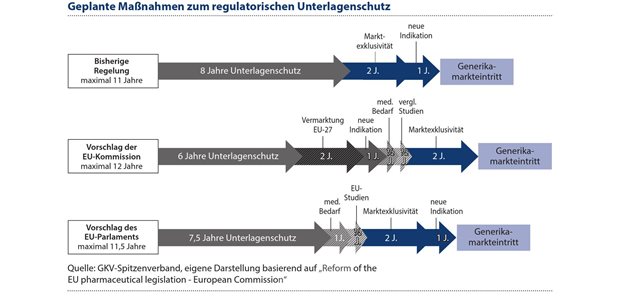
Abbildung 1: Nach den Plänen der EU-Kommission würde der Zeitraum auf maximal zwölf Jahre Marktschutz erhöht werden, während die Pläne des EU-Parlaments einen maximalen Zeitraum von elfeinhalb Jahren vorsehen.
© GKV-Spitzenverband
Das Problem der antimikrobiellen Resistenzen
Resistente Erreger machen nicht an den Landesgrenzen halt. Die steigende Zahl an mikrobiellen Resistenzen ist daher eine gemeinsame europäische Herausforderung. Anhand der vom Wissenschaftlichen Institut der Ortskrankenkassen (WIdO) vorgelegten Zahlen zum Verordnungsgeschehen der Antibiotika in Deutschland, zeigte sich ein deutlicher Anstieg der Verordnungen bei Reserveantibiotika. Die Anzahl der Verordnungen der nur sparsam einzusetzenden Arzneimittel stieg 2023 um 18,4 Prozent im Vergleich zum Vorjahr.3 Gerade mit der steigenden Zahl an Verordnungen von Reserveantibiotika steigt auch das Risiko von Resistenzen. Wichtig ist vor allem, die Entwicklung schwerwiegender oder resistenter Infektionen im Vorfeld zu verhindern und den Einsatz insbesondere von Reserveantibiotika in der Human- und Tiermedizin auf ein nötiges Minimum zu begrenzen.

Abbildung 2: Durch längeren Unterlagenschutz oder Marktexklusivität verzögert sich der Eintritt des Generikawettbewerbs. Jedes Jahr zusätzlicher Schutz bedeutet Mehrausgaben für die GKV in Höhe von mehr als einer Milliarde Euro.
© GKV-Spitzenverband
Darüber hinaus ist auch weitere Forschung an antimikrobiellen Therapien nötig, die bei Erregern mit kritischer Resistenzsituation eingesetzt werden können. Die EU-Kommission und das EU-Parlament möchten als Anreiz für das Entwickeln eines Arzneimittels gegen solche prioritären Pathogene, übertragbare Gutscheine, die sogenannten „Voucher“, einführen. Nach Zulassung des Arzneimittels erhält das pharmazeutische Unternehmen einen Gutschein über maximal zwölf Monate zusätzlichen Unterlagenschutz.
Dieser Gutschein kann einmalig weiterverkauft werden. Es ist somit davon auszugehen, dass diese Gutscheine von pharmazeutischen Unternehmen erworben werden, die ihn für Arzneimittel mit hohem Umsatz einsetzen möchten. Diese Prognose unterstützt auch der Bericht der Folgenabschätzung der EU-Kommission.4 Dadurch würden nicht primär die Unternehmen profitieren, die das Antibiotikum entwickelt haben, sondern die Unternehmen, die den Gutschein für besonders umsatzstarke Arzneimittel erworben haben.
Diese sogenannten „Windfall Profits“ würden eine unverhältnismäßige Belastung der Finanzierbarkeit des deutschen Gesundheitssystems darstellen, ohne einen effektiven und zielgerechten Nutzen für die forschenden Unternehmen zu bringen. In der kritischen Phase der Entwicklung des Arzneimittels stellen Voucher ebenfalls keine Hilfe für die forschenden Unternehmen dar. Alternativen, die Unternehmen schon während der Forschung unterstützen, sind sogenannte „Push & Pull Incentives“.
Ein Vorschlag für dieses Anreizsystem findet sich in der Position des EU-Parlaments. Im Rahmen eines „Milestone Payment Programms“ sollen bestimmte Meilensteine schon während der Forschungsphase, z. B. das Beenden der klinischen Phase I, mit Unterstützungsgeldern belohnt werden. Während diese Unterstützungsgelder zu den „Push-Incentives“ gezählt werden, sind garantierte Abnahmemengen von den oft mit niedrigem Umsatz assoziierten Arzneimitteln klassische „Pull-Incentives“.
Das Problem wird nicht allein durch das Entwickeln von neuen Wirkstoffen gelöst werden können, sondern der Einsatz der vorhandenen Wirkstoffe muss rational und sparsam erfolgen.
Zögerliche Reformen bei „Orphan Drugs“
Ähnlich wie aktuell bei Reserveantibiotika wurden auch die Sonderregelungen für Arzneimittel für seltene Leiden („Orphan Drugs“) einst mit der Diagnose eines Marktversagens begründet. Bei Erkrankungen, die weniger als 5 von 10.000 Personen in der EU betreffen, ging man davon aus, dass Arzneimitteltherapien – ohne weitere Anreize – nicht wirtschaftlich entwickelt werden könnten. In Anbetracht der Entwicklungen der letzten 25 Jahre lässt sich diese generelle These nicht weiter aufrechterhalten.
Auf der einen Seite bleiben viele sehr seltene Erkrankungen weiter unerforscht, auf der anderen Seite hat sich bei einigen vergleichsweise häufigen, chronischen „Orphan Diseases“ eine erhebliche Marktdynamik mit hohen Profiten entwickelt („Clustering“). Um die Förderung von Therapien für seltene Leiden für die nächsten 25 Jahre auf ein stabiles Fundament zu stellen, wäre eine Re-Fokussierung der Anreize auf tatsächliche Fälle eines Marktversagens bei hochseltenen Erkrankungen und auf echte therapeutische Durchbrüche dringend notwendig.
Der Entwurf zum Critical Medicines Act
Mit der COVID-Pandemie und den damit verbundenen Turbulenzen im Welthandel ist die Liefersicherheit von Arzneimitteln auf die politische Agenda gelangt. Es ist die Verpflichtung der pharmazeutischen Unternehmen und Großhändlern, innerhalb ihrer Verantwortungsbereiche eine angemessene und kontinuierliche Bereitstellung des entsprechenden Arzneimittels sicherzustellen, damit der Bedarf von Patientinnen und Patienten gedeckt ist (Paragraf 52b Absatz 1 Arzneimittelgesetz bzw. Artikel 81 der Richtlinie 2001/83/EG). Mit dem Entwurf eines „Critical Medicines Act“ stellt sich nun die Frage, wie diese Verpflichtung durch ergänzende Regelungen flankiert werden kann, um die Arzneimittelversorgung auch tatsächlich sicherzustellen.
Vielfältige, komplizierte Ursachen von Lieferengpässen
Arzneimittel-Lieferengpässe können vielfältige Ursachen haben: Schon während der Produktion eines Wirkstoffs kann es zu Problemen kommen. Als prominentes Beispiel aus der Vergangenheit sind hier die Nitrosamin-Verunreinigungen bei der Produktion der Sartane zu nennen. Wenn hier die Herstellung des Wirkstoffes nicht durch andere Hersteller ausgeglichen werden kann, kann es zu weitreichenden Liefer- und Versorgungsengpässen kommen.
Nach der Wirkstoffherstellung werden diese oftmals nach Europa für die Sekundärproduktion des Arzneimittels transportiert. Transportprobleme können auftreten, wie zum Beispiel eine Blockade wichtiger Zulieferwege. Als Stichwort ist der Vorfall am Suez-Kanal vor ungefähr vier Jahren zu nennen, bei dem ein Frachtschiff diesen global wichtigen Transportweg blockierte. Sind die Arzneimittel bereits produziert, kann es dennoch Fehlkalkulationen bei den Beständen geben. Vor allem, wenn die Prozesse der Bestandsprüfung nicht komplett digitalisiert sind.
Zudem kann, u.a. durch saisonale Schwankungen der Morbidität, ein unvorhersehbarer Anstieg der Nachfrage für einen Lieferengpass verantwortlich sein. Für die vielfältigen Ursachen von Lieferengpässen gibt es auch vielfältige, geeignete Maßnahmen. Wichtig ist, dass diese evidenzbasiert und transparent sind. Isolierte Preissteigerungen, ohne damit verbundene Verpflichtungen, sind daher nicht geeignet. Ein geeignetes Instrument ist die Diversifizierung der Anbieter in Produktions- und Lieferkette. Hierdurch soll Europa weniger abhängig von einzelnen Produzenten aus Drittstaaten werden. Eine geeignete Lagerhaltung, die auf digitale Erfassungssysteme setzt, kann Transport- und Logistikprobleme abdämpfen. In Zeiten von saisonal erhöhtem Bedarf bestimmter Arzneimittel kann eine verbesserte und digitale Bedarfsplanung helfen (siehe Abbildung 3).
Vorgeschlagene Maßnahmen
Der nun veröffentlichte Entwurf des Critical Medicines Act muss sinnvoll mit der Arzneimittel-Reform verzahnt sein. Das Zusammenspiel der Rechtsakte kann z. B. genutzt werden, um ein EU-weites Frühwarnsystem für Lieferengpässe einzurichten. Dies könnte als wichtiges Werkzeug zur Engpassvermeidung genutzt werden. Um Lieferengpässe zukünftig vermeiden zu können, sollten Zulassungsinhaber drohende Lieferengpässe rechtzeitig melden.
Neben der prioritären Bearbeitung für sogenannte „strategische Projekte“ sieht der Entwurf die Aufforderung zur prioritären Belieferung der EU-Mitgliedstaaten für Arzneimittel vor, die von Staatshilfen profitiert haben. Außerdem sollen für „kritische Arzneimittel“ und „Arzneimittel von gemeinsamem Interesse“ neue verpflichtende Vergabekriterien eingeführt werden.5 Ein verpflichtender Einbezug würde einen starken Eingriff in die deutsche Arzneimittelversorgung und die Gestaltungsfreiheit der Rabattverträge bedeuten. Auch der bürokratische Aufwand wäre immens. Zudem sind mit der vorgeschlagenen Regelung Rechtsunsicherheiten hinsichtlich der Behandlung von Vertragsstaaten des EWR und anderer Übereinkommen gegeben. Diese Rechtsunsicherheit muss vor Einführung des Critical Medicines Act in geltendes EU-Recht geklärt werden.
Durchsetzung der Herstellverantwortung
Bereits im bestehenden Recht ist der Zulassungsinhaber verpflichtet, im Rahmen seiner Verantwortung, eine angemessene und kontinuierliche Bereitstellung seiner Produkte sicherzustellen. Solange diese Regelungen jedoch weder sanktioniert noch durchgesetzt werden, besteht ein Anreiz, kostensenkende Maßnahmen vorzunehmen, die zu einer größeren Anfälligkeit der Lieferkette führen. Erst durch entsprechende Sanktionen entsteht im Wettbewerb ein Anreiz, höhere Produktionskosten in Kauf zu nehmen, um damit etwaigen Strafzahlungen zu entgehen. Ohne Sanktionen aber bleiben auch Neuregelungen, die nur zu „größtmöglichen Bemühungen“ anhalten, letztlich wahrscheinlich folgenlos.
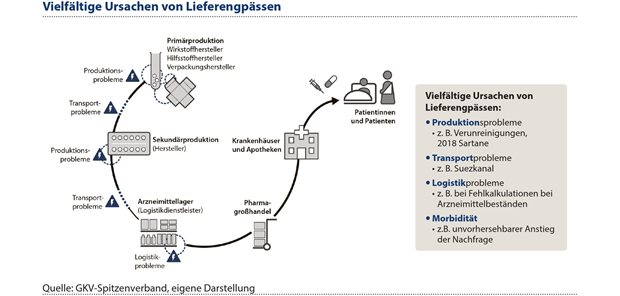
Abbildung 3: Wichtig ist, dass Instrumente gegen Lieferengpässe evidenzbasiert und transparent sind. Ein geeignetes Instrument ist zum Beispiel die Diversifizierung der Anbieter in Produktions- und Lieferkette.
© GKV-Spitzenverband
Bevorratung
Im deutschen Recht bestehen bereits weitreichende Vorschriften zur Bevorratung von Arzneimitteln. So müssen zum Beispiel Arzneimittel, für die ein Rabattvertrag abgeschlossen wurde, sechs Monate versorgungsnah bereitgehalten werden. Ergänzend zu den deutschen Regelungen kann eine freiwillige Nutzung des EU-Solidaritätsmechanismus für Arzneimittel unter europäischer Koordination für Krisenfälle genutzt werden. Oft liegt dem Lieferengpass ein Problem bei der Lieferung des Wirkstoffes zu Grunde. Deshalb könnte innerhalb des Critical Medicines Act geprüft werden, ob eine Bevorratung von Wirkstoffen als strategische EU-Reserve sinnvoll wäre. Eine effektive Bevorratung von Arzneimitteln und eine effiziente Koordination in Krisenfällen setzt voraus, dass die Bestände digital und in Echtzeit erfasst und verfolgt werden können.
Ausblick
2025 ist ohne Zweifel ein spannendes Jahr für die europäische Arzneimittelgesetzgebung. Auch in Hinblick auf geopolitische und handelspolitische Spannungen in der heutigen Zeit, braucht es gemeinsame, europäische Lösungen und dabei effiziente und agile Versorgungsstrukturen. Vor allem braucht es innovative Lösungen, die auf der einen Seite eine effiziente und qualitativ hochwertige Versorgung mit Arzneimitteln ermöglicht und gleichzeitig die finanzielle Stabilität der Gesundheitssysteme gewährleistet.

© GKV-Spitzenverband, Fotografin Jenny Sieboldt

© GKV-Spitzenverband, Fotografin Jenny Sieboldt

© GKV-Spitzenverband, Fotografin Jenny Sieboldt
Literatur
1 Reform of the EU pharmaceutical legislation – European Commission https://health.ec.europa.eu/medicinal-products/legal-framework-governing-medicinal-products-human-use-eu/reform-eu-pharmaceutical-legislation_en (Stand: 21.03.2025)
2 Berechnungen zum Mehrumsatz durch Exklusivitätsschutz – DSV https://dsv-europa.de/lib/Hintergrund/2024-03-07-DSV-Berechnungen-zum-Mehrumsatz-durch-Exklusivitaetsschutz.pdf (Stand 20.02.2025)
3 Tagesspiegel: „Antibiotika-Verbrauch steigt um fast ein Fünftel: Im Saarland wird am großzügigsten verordnet“ https://www.tagesspiegel.de/gesundheit/antibiotika-verbrauch-steigt-um-fast-ein-funftel-im-saarland-wird-am-grosszugigsten-verordnet-13241926.html (Stand 24.02.2025)
4 Impact assessment report and executive summary accompanying the revision of the general pharmaceutical legislation – European Commission https://health.ec.europa.eu/publications/impact-assessment-report-and-executive-summary-accompanying-revision-general-pharmaceutical_en (Stand: 21.03.2025)
5 Critical Medicines Act – European Commission https://health.ec.europa.eu/medicinal-products/legal-framework-governing-medicinal-products-human-use-eu/critical-medicines-act_en (Stand: 21.03.2025)