Welche Endpunkte sind patientenrelevant?
Validierung von Surrogatendpunkten
Ein Surrogatendpunkt (oder Surrogat-Outcome) soll ein klinisches Ergebnis ersetzen, um neue Behandlungen zu bewerten, wenn er günstiger, einfacher, häufiger oder früher messbar ist. Ein solcher Surrogatendpunkt soll den klinischen Nutzen, Schaden oder das Fehlen eines solchen vorhersagen. Für eine quantitative Bewertung der Evidenzstärke zur Surrogatfähigkeit müssen zwei Punkte nachgewiesen werden: die prognostische Relevanz des Surrogats für das klinische Ergebnis und dass die Behandlungseffekte auf das Surrogat zuverlässig die Effekte auf das klinische Ergebnis vorhersagen. Dieser Prozess der Erbringung der Evidenz wird als Validierung des Surrogats bezeichnet. Zu diesem Zweck wird meist der sogenannte meta-analytische Ansatz verwendet, bei dem Daten aus mehreren randomisierten klinischen Studien analysiert werden.
Veröffentlicht:
© magele-picture / stock.adobe.com
In den von der Koordinierungsgruppe der Mitgliedstaaten (MS) für die Bewertung von Gesundheitstechnologien (HTA) verabschiedeten „Leitlinien zu Ergebnissen für gemeinsame klinische Bewertungen“ (HTA CG, 2024) heißt es: „Surrogatendpunkte können einen direkten patientenbezogenen Nutzen widerspiegeln oder auch nicht, und ihre klinische Relevanz und Eignung für die gemeinsame klinische Bewertung (Joint Clinical Assessment, JCA) muss von den Mitgliedstaaten berücksichtigt werden.“ Was sind Surrogatendpunkte?
In der Leitlinie heißt es: „Ein Surrogatendpunkt ist ein Ergebnis, das ein relevantes Ergebnis ersetzen soll, das in einer spezifischen klinischen Studie nicht beobachtet werden kann. (…) Von einem Surrogatendpunkt wird erwartet, dass er lediglich den Behandlungseffekt eines Ergebnisses vorhersagt, das in einer klinischen Studie nicht beobachtet wurde.“ Bei der Erörterung der Verwendung von Surrogatendpunkten heißt es in der Leitlinie, dass diese „(...) gegebenenfalls zusätzlich zu patientenrelevanten Endpunkten angefordert werden können. Es sollten jedoch nach Möglichkeit nur Surrogatendpunkte herangezogen werden, wenn ihre Validität zuvor eindeutig nachgewiesen wurde.“ Damit wird das Konzept der „Validität eines Surrogatendpunkts“ vorangebracht.
Die Validität bezieht sich auf „die Stärke der Assoziation zwischen dem Surrogatendpunkt und dem relevanten Endpunkt sowie auf die Assoziation zwischen den Behandlungseffekten auf den Surrogatendpunkt und den relevanten Endpunkt“. Da die Leitlinie besagt, dass Entwickler von Gesundheitstechnologien „die Stärke des Zusammenhangs nachweisen“ sollten, wenn ein Surrogatendpunkt verwendet wird. Dieses Kriterium entspricht dem sogenannten meta-analytischen Rahmenwerk zur Validierung von Surrogatendpunkten (Buyse et al., 2000).
Tatsächlich wird dieser Ansatz ausdrücklich in der Leitlinie erwähnt: „Es gibt mehrere andere nützliche Ansätze zur Validierung von Surrogatendpunkten. Im Allgemeinen basieren diese Methoden auf einem meta-analytischen Ansatz.“ Es ist erwähnenswert, dass die Leitlinie auch ein Validitätsmaß nennt, das spezifisch für den meta-analytischen Ansatz ist, nämlich den Surrogat-Schwelleneffekt (Surrogate Threshold Effect, STE): „Das Konzept der Surrogate-Schwelleneffekts ist hilfreich für die Entscheidungsfindung, da sie den Mindesteffekt in Bezug auf den Surrogatendpunkt darstellt, der erforderlich ist, um zu dem Schluss zu kommen, dass mit hoher Sicherheit auch ein Effekt auf den patientenrelevanten Endpunkt vorliegt.“
Im Folgenden werden die in der HTA-CG-Leitlinie erwähnten Konzepte und Methoden näher erläutert.
Im meta-analytischen Ansatz (Buyse et al., 2000) werden Daten aus historischen klinischen Studien verwendet, um die Stärke der Assoziation zwischen den Behandlungseffekten auf den relevanten Endpunkt und auf den Surrogatendpunkt zu bewerten. Dies wird als Assoziation auf Studienebene (Trial-Level-Assoziation) bezeichnet. Die Stärke der Assoziation wird mit dem Korrelationskoeffizienten R oder dem Bestimmtheitsmaß R2 gemessen, die sich aus einem linearen Regressionsmodell ergeben, das an die geschätzten Behandlungseffekte angepasst wurde.
Je stärker die Assoziation, desto präziser ist die Vorhersage des Behandlungseffekts auf den relevanten Endpunkt basierend auf dem Effekt auf den Surrogatendpunkt. Die Konzentration auf die Stärke der Assoziation ergibt sich aus der Tatsache, dass – wie bereits erwähnt – die Vorhersage das Hauptziel der beabsichtigten Verwendung eines Surrogats ist.
Darüber hinaus werden beim meta-analytischen Ansatz Daten aus historischen klinischen Studien verwendet, um die Stärke der Assoziation zwischen dem relevanten Ergebnis und dem Surrogatendpunkt zu bewerten. Dies wird als Assoziation auf individueller Ebene (Individual-Level-Assoziation) bezeichnet. Sie wird in der Regel anhand eines Assoziationsmaßes (z. B. Korrelationskoeffizient, Odds Ratio) erfasst, das auf einem bivariaten Modell basiert, das an die individuellen Patientendaten angepasst wird und mögliche Behandlungseffekte berücksichtigt. Je stärker die Assoziation ist, desto genauer ist die Vorhersage des relevanten Ergebnisses auf der Grundlage des für einen Patienten beobachteten Surrogatwertes.
Ein Surrogat, das auf individueller Ebene gültig ist, kann nützlich sein, um z. B. die Behandlungsbedürfnisse eines Patienten individuell anzupassen (Buyse et al., 2022). Für ein solches Surrogat folgt jedoch nicht unmittelbar, dass behandlungsbedingte Veränderungen des Surrogats eng mit den entsprechenden Veränderungen am klinischen Endpunkt verbunden sind, d. h. dass das Surrogat auf Studienebene gültig ist. Im letzteren Fall ist eine direkte Bewertung der Stärke der Assoziation auf Studienebene erforderlich (Buyse, 2016; Buyse et al., 2022).
Um die Konzepte und Herausforderungen im Zusammenhang mit der Validierung von Surrogatendpunkten zu veranschaulichen, betrachten wir drei Beispiele für eine solche Validierung anhand eines meta-analytischen Ansatzes. Insbesondere werden zwei Meta-Analysen von randomisierten klinischen Studien zum Magenkarzinom und eine Meta-Analyse von randomisierten Studien zum kolorektalen Karzinom diskutiert.
Die erste Meta-Analyse von Studien zum Magenkarzinom schloss Patienten mit fortgeschrittenem Karzinom ein (Paoletti et al., 2013). Ziel war die Bewertung des progressionsfreien Überlebens (PFS) als Surrogat für das Gesamtüberleben (OS). Es lagen Daten von 4.069 Patienten aus 20 relevanten randomisierten Studien mit dokumentiertem OS und PFS vor. Die Studien untersuchten den Zusatz von experimentellen Chemotherapeutika zu bereits vorhandenen Kontroll- oder Standardtherapien. Der Spearman-Rangkorrelationskoeffizient, der die Assoziation zwischen OS und PFS auf individueller Ebene quantifiziert, betrug 0,853 (95 % KI [0,852, 0,854]).
Wie in der HTA-CG-Leitlinie [HTA CG, 2024] erwähnt, „gibt es keinen allgemein akzeptierten Schwellenwert für die Feststellung ausreichender Korrelationen zwischen dem Surrogat und dem patientenzentrierten Ergebnis auf Studienebene (d. h. Korrelation der Wirkungen) und auf Patientenebene (d. h. Korrelation der Ergebnisse). Eine Korrelation von mindestens 0,85 wird jedoch als „hoch“ beschrieben und kann als Kriterium für die Validierung von Surrogat-Endpunkten verwendet werden.“ Geht man von einem Schwellenwert von 0,85 aus, ist das PFS ein gültiges Surrogat auf individueller Ebene für das OS.
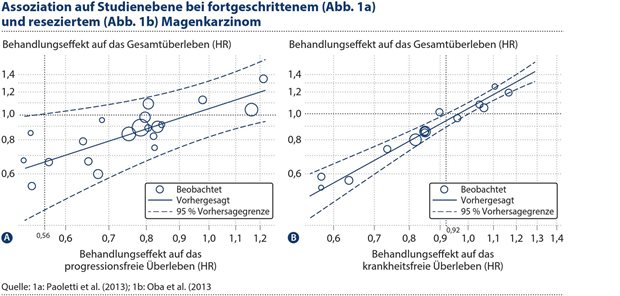
Abbildung 1: Panel A: Assoziation auf Studienebene für das Beispiel des fortgeschrittenen Magenkarzinoms.Panel B: Assoziation auf Studienebene für das Beispiel des resezierten Magenkarzinoms. Die Kreise (deren Größe proportional zum Stichprobenumfang der Studie ist) stellen die Paare der geschätzten Behandlungseffekte auf das Surrogat und das Gesamtüberleben dar. Die durchgezogene gerade Linie ist die lineare Regression, die den vorhergesagten Behandlungseffekt auf das Gesamtüberleben angibt. Die gestrichelte vertikale Linie zeigt den Surrogat-Schwelleneffekt an. Es ist zu beachten, dass beide Achsen auf einer logarithmischen Skala liegen.
© Springer Medizin Verlag
Die Assoziation auf Studienebene zwischen den Behandlungseffekten auf das PFS und OS wird in Abbildung 1A dargestellt. Das lineare Regressionsmodell war:
ln(HROS) = 0,042 + 0,779 x ln(HRPFS), wobei ln(HROS) und ln(HRPFS) die Logarithmen des Hazard Ratios (HR) für das OS bzw. PFS darstellen. Nach Bereinigung des Schätzfehlers wurde R2 auf 0,61 (95 % KI [0,04, 1,00]) geschätzt. Das breite Konfidenzintervall spiegelt die Unsicherheit dieser Schätzung wider, was teilweise auf die kleinen Stichprobengrößen einiger der in die Meta-Analyse einbezogenen Studien zurückzuführen ist. Der Korrelationskoeffizient (R), der R2 entspricht, beträgt 0,781. Bei Verwendung des Schwellenwerts von 0,85 ist PFS kein gültiges Surrogat auf Studienebene für das OS.
Die Ergebnisse wurden extern validiert, indem 12 Studien verwendet wurden, die nicht in die Meta-Analyse einbezogen waren und für die die Behandlungseffekte aus Berichten extrahiert wurden, die nach Abschluss der Meta-Analyse veröffentlicht wurden. Abbildung 2A zeigt die gleiche Regressionslinie wie in Abbildung 1A. Die beobachteten Behandlungseffekte auf das Überleben (HROS) werden für diese 12 Studien dargestellt, ebenso wie die aus den Behandlungseffekten des Surrogats (HRPFS) in diesen Studien vorhergesagten Behandlungseffekte auf das OS, einschließlich ihrer 95 %-Vorhersageintervalle.
Wie in Abbildung 2A zu sehen ist, waren die Vorhersageintervalle breit und schlossen für alle Studien den Wert von 1 (kein Behandlungseffekt auf das OS) ein, was bedeutet, dass die beobachteten Effekte auf das PFS in keiner der 12 Studien einen signifikanten Effekt auf das OS hätten vorhersagen können. Dennoch zeigten drei der 12 Studien einen statistisch signifikanten Effekt der Behandlung auf das Überleben (Paoletti et al., 2013). Insgesamt scheint das PFS kein gültiges Surrogat auf Studienebene für das OS bei fortgeschrittenem Magenkarzinom zu sein.
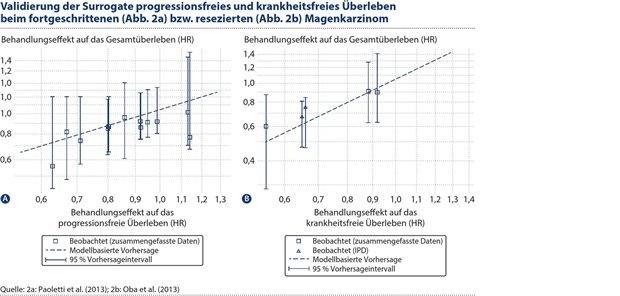
Abbildung 2. Panel A: Validierungsdaten für das Beispiel des fortgeschrittenen Magenkarzinoms. Panel B: Validierungsdaten für das Beispiel des resezierten Magenkarzinoms. Die gestrichelte gerade Linie ist die lineare Regression, die den vorhergesagten Behandlungseffekt auf das Gesamtüberleben angibt. Die Kästen sind die geschätzten Behandlungseffekte auf das Gesamtüberleben für die Validierungsstudien. Die vertikalen Intervalle sind die 95 %-Vorhersageintervalle für den Behandlungseffekt auf das Gesamtüberleben. Es ist zu beachten, dass beide Achsen auf einer logarithmischen Skala liegen.
© Springer Medizin Verlag
Die zweite Meta-Analyse von Studien zum Magenkarzinom schloss Patienten mit reseziertem Karzinom ein (Oba et al., 2013). Ziel war die Bewertung des krankheitsfreien Überlebens (DFS) als Surrogat für das OS. Es lagen Daten von 3.371 Patienten aus 14 Studien mit dokumentiertem OS und DFS vor. In den Studien wurde eine adjuvante Chemotherapie mit einer alleinigen Operation verglichen. Basierend auf individuellen Patientendaten wurde der Spearman-Rangkorrelationskoeffizient, der die Assoziation zwischen OS und DFS auf individueller Ebene quantifiziert, auf 0,974 (95 % KI [0,971, 0,976]) geschätzt. Bei Verwendung des Schwellenwerts von 0,85 ist DFS ein gültiges Surrogat auf individueller Ebene.
Auf Studienebene gab es ebenfalls eine enge Assoziation zwischen den Behandlungseffekten auf das DFS und das OS (siehe Abbildung 1B). Das lineare Regressionsmodell war: ln(HROS) = 0,047 + 1,239 x ln(HRDFS).
Nach Bereinigung des Schätzfehlers wurde R2 auf nahezu 1 (95 % KI [0.999, 1.000]) geschätzt, wobei der entsprechende Wert des Korrelationskoeffizienten R ebenfalls nahe bei 1 lag. (Die erzielten numerischen Ergebnisse sind jedoch mit Vorsicht zu genießen, da der geschätzte Wert von R2 sehr nahe an der Obergrenze von 1 liegt.) Man könnte also schlussfolgern, dass DFS ein gültiges Surrogat auf Studienebene für das OS ist.
Die Ergebnisse wurden extern validiert, indem fünf Studien verwendet wurden, die nicht in die Meta-Analyse einbezogen waren. Drei davon stammten aus veröffentlichten Berichten, und zwei basierten auf individuellen Patientendaten, die nach Abschluss der Meta-Analyse verfügbar wurden. Abbildung 2B zeigt die gleiche Regressionslinie wie in Abbildung 1B. Die beobachteten Behandlungseffekte auf das Überleben (HROS) werden für diese fünf Studien dargestellt, ebenso wie die aus den Behandlungseffekten des Surrogats (HRDFS) in diesen Studien vorhergesagten Behandlungseffekte auf das Überleben, einschließlich ihrer 95 %-Vorhersageintervalle. Es besteht eine sehr gute Übereinstimmung zwischen den beobachteten und vorhergesagten Behandlungseffekten, und in den drei Studien, in denen die Vorhersagegrenzen von HROS den Wert 1 ausschlossen, erreichten die beobachteten Effekte auf das Überleben tatsächlich statistische Signifikanz (Paoletti et al., 2013). Insgesamt ist das DFS ein gültiges Surrogat sowohl auf individueller als auch auf Studienebene für das OS bei resezierbarem Magenkarzinom.
Abbildung 1 veranschaulicht die zuvor erwähnte Verbindung zwischen der Stärke der Assoziation auf Studienebene und der Genauigkeit der Vorhersage des Behandlungseffekts auf das klinische Ergebnis. In Abbildung 1A sind die Vorhersagegrenzen für die Auswirkung auf das OS breit; in diesem Fall war der Wert von R2=0,61 (mit R=0,781) deutlich kleiner als 1. Andererseits sind die Vorhersagegrenzen in Abbildung 1B eng; in diesem Fall waren R2 (und R) sehr nahe bei 1. Je höher also R2 oder R, desto präziser ist die Vorhersage. Das ist der Grund, warum im meta-analytischen Ansatz die Validität eines Surrogats auf Studienebene durch Quantifizierung der Stärke der Assoziation auf Studienebene beurteilt wird. Ein ähnliches Argument gilt für die Assoziation auf individueller Ebene.
Die in Abbildung 1 dargestellten Vorhersagegrenzen veranschaulichen auch das Konzept des Surrogat-Schwelleneffekts (STE). Der STE ist der minimale Behandlungseffekt auf das Surrogat, der eine Vorhersage eines (von Null verschiedenen) Effekts auf das klinische Ergebnis ermöglicht. Praktisch ausgedrückt ist der STE für die betrachteten Beispiele der Wert der HR für das Surrogat, bei dem die obere Vorhersagegrenze, die aus der Regressionslinie abgeleitet wurde, gleich 1 wird. In Abbildung 1 ist der Wert durch die gestrichelte vertikale Linie dargestellt. Für das Beispiel des fortgeschrittenen Magenkarzinoms war der STE gleich 0,56.
Das bedeutet, dass ein HR-Wert für das PFS, der kleiner ist als 0,56, mit 95-prozentiger Sicherheit einen HR-Wert für das OS vorhersagen würde, der kleiner als 1 ist. Der STE von 0,56 impliziert eine deutliche Verringerung des Risikos um 44 %. Betrachtet man die Bandbreite der HR-Werte für das PFS, die in den Studien in Abbildung 1A beobachtet wurden, so stellt HR=0,56 einen ziemlich extremen Behandlungseffekt dar. Das ist eine Folge der breiten Vorhersagegrenzen in Abbildung 1A. Somit scheint das PFS kein nützliches Surrogat zu sein, da man einen großen Effekt auf das PFS benötigen würde, um von einem Effekt auf da OS sprechen zu können. Diese Schlussfolgerung stimmt mit derjenigen überein, die zuvor aus dem Wert von R2 abgeleitet wurde.
Für das Beispiel des resezierten Magenkarzinoms betrug der STE hingegen 0,92 (siehe Abbildung 1B). Dies ist ein kleiner Behandlungseffekt, der eine Verringerung des Risikos um nur 8 % impliziert. Dieser geringe STE ist eine Folge der engen Vorhersagegrenzen in Abbildung 1B. Somit ist das DFS ein nützliches Surrogat, denn man müsste einen kleinen Effekt auf das DFS haben, um einen Effekt auf das OS behaupten zu können. Diese Schlussfolgerung deckt sich mit derjenigen, die sich aus dem Wert von R2 ergibt.
Die beiden Beispiele zum Magenkarzinom veranschaulichen, wie eine quantitative Bewertung die Verwendung von Surrogatendpunkten beeinflussen kann; obwohl diese beiden Situationen relativ ähnlich erscheinen, kommen wir zu unterschiedlichen Schlussfolgerungen hinsichtlich der Verwendung von PFS und DFS als Surrogat für das OS. Tatsächlich könnte man argumentieren, dass das DFS als angemessenes Surrogat für das OS in der adjuvanten Therapie verwendet werden kann, während das PFS nicht zuverlässig als Surrogat bei fortgeschrittener Krankheit verwendet werden kann.
Die Meta-Analyse von Studien für Patienten mit fortgeschrittenem kolorektalem Karzinom wurde durchgeführt, um das progressionsfreie Überleben (PFS) als Surrogat für das OS zu bewerten [Buyse et al., 2007]. Es lagen Daten von 4.352 Patienten aus 13 Studien vor. Die Studien umfassten 10 historische Studien, in denen Fluorouracil (FU) in Kombination mit Leucovorin entweder mit FU allein (1.744 Patienten) oder mit Raltitrexed (1.345 Patienten) verglichen wurde, sowie drei Validierungsstudien, in denen FU + Leucovorin mit oder ohne Irinotecan oder Oxaliplatin (1.263 Patienten) verglichen wurde. Der Spearman-Rangkorrelationskoeffizient, der die Assoziation zwischen OS und PFS auf individueller Ebene quantifiziert, betrug 0,82 (95 % KI [0,82, 0,83]). Streng genommen liegt der Wert unter 0,85, was darauf hindeuten könnte, dass das PFS kein gültiges Surrogat auf individueller Ebene ist.
Auf Studienebene gab es eine enge Assoziation zwischen den Behandlungseffekten auf das PFS und das OS. Das lineare Regressionsmodell war:
ln(HROS) = 0,003 + 0,81 x ln(HRPFS)
Der Wert von R2 wurde auf 0,98 (95 % KI [0,88, 1,08]) geschätzt, mit einem entsprechenden R-Wert von 0,99. Bei Verwendung des Schwellenwerts von 0,85 ist PFS ein gültiges Surrogat auf Studienebene für das OS.
Die Ergebnisse wurden extern validiert, indem drei (neuere) Studien verwendet wurden, die nicht in die Meta-Analyse einbezogen waren. Die vorhergesagten Wirkungen stimmten in den Studien, in denen Irinotecan getestet wurde, sehr gut mit den beobachteten Wirkungen überein, weniger gut jedoch in der Studie, in der Oxaliplatin getestet wurde, wo die vorhergesagte Wirkung die beobachtete Wirkung überschätzte (siehe Abbildung 3). Der Unterschied könnte auf die Wirkung von Zweitlinientherapien und Crossovers zurückzuführen sein, die im Vergleich zu den historischen Studien in größerem Umfang verfügbar waren.
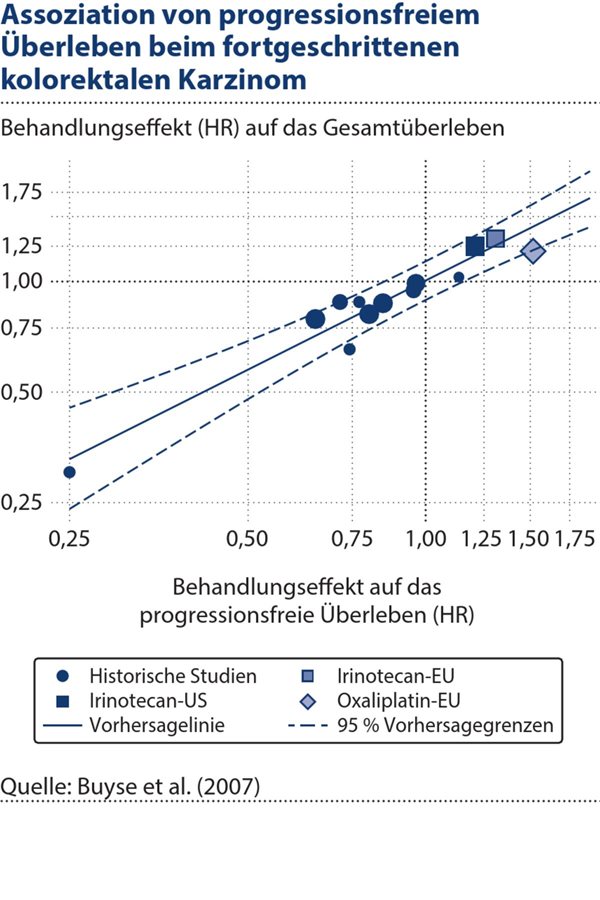
Abbildung 3. Assoziation auf Studienebene für das Beispiel des fortgeschrittenen kolorektalen Karzinoms. Die Kreise (deren Größe proportional zum Stichprobenumfang der Studie ist) stellen die Paare der geschätzten Behandlungseffekte auf das Surrogat und das Gesamtüberleben dar. Die durchgezogene gerade Linie ist die lineare Regression, die den vorhergesagten Behandlungseffekt auf das Gesamtüberleben angibt. Die Quadrate entsprechen den Ergebnissen der beiden Validierungsstudien, in denen der Zusatz von Irinotecan untersucht wurde. Die Raute entspricht den Ergebnissen der Validierungsstudie, in der der Zusatz von Oxaliplatin untersucht wurde. Es ist zu beachten, dass beide Achsen auf einer logarithmischen Skala liegen.
© Springer Medizin Verlag
In diesem Zusammenhang ist anzumerken, dass das PFS unter der Erstlinientherapie gemessen wird, während das OS unter Folgetherapien gemessen wird, die den Effekt der Erstlinientherapie auf das klinische Ergebnis verzerren können. Dies könnte erklären, warum das PFS in einer Ära marginal wirksamer FU-basierter Therapien (Buyse et al., 2007) ein akzeptables Surrogat für das OS bei fortgeschrittenem kolorektalem Karzinom war, während es heute ein viel weniger überzeugendes Surrogat ist, da Patienten mit fortschreitender Erkrankung viele aktive Therapielinien erhalten können, die ihr Überleben weiter beeinflussen können (Shi et al., 2014).
Das Beispiel des kolorektalen Karzinoms zeigt somit, dass sich die Aussagekraft eines Surrogats im Laufe der Zeit ändern kann. Zudem zeigt der Vergleich mit dem Beispiel des fortgeschrittenen Magenkarzinoms, dass die Gültigkeit desselben Surrogats (PFS) bei verschiedenen Krankheiten unterschiedlich sein kann. Daraus folgt, dass man die Gültigkeit eines Surrogats nicht einfach aus einer Validierungsübung ableiten kann, die bei einer anderen Krankheit durchgeführt wurde (Buyse, 2016). Eine damit verbundene und vielleicht die schwierigste Frage ist, ob ein Surrogat, das für eine bestimmte Medikamentenklasse evaluiert wurde, auch für andere Klassen von Arzneimitteln gültig ist.
In den meisten Fällen ist eine Kombination aus biologischen Überlegungen und statistischem Nachweis erforderlich, um ein Surrogat außerhalb der Bedingungen zu verwenden, unter denen es ursprünglich evaluiert wurde. Statistische Beweise, die für die Verwendung des Surrogats sprechen, sind am hilfreichsten für neue Medikamente, die den in den Bewertungsdatensätzen verwendeten Arzneimitteln ähnlich sind. Bei neuen Medikamenten mit einem wesentlich anderen Wirkmechanismus bleibt die Frage offen, ob das Surrogat zuverlässig verwendet werden kann, was möglicherweise eine weitere prospektive Bewertung notwendig macht.
Aus praktischer Sicht erfordert der meta-analytische Ansatz zur Validierung von Surrogatendpunkten die Verfügbarkeit von individuellen Patientendaten aus mehreren randomisierten klinischen Studien, in denen Informationen über das Surrogat und die klinischen Ergebnisse verfügbar sind. Trotz bestehender Initiativen zur gemeinsamen Nutzung von Daten stellt die Beschaffung solcher Daten immer noch eine Herausforderung dar.
Und selbst wenn der Zugang zu solchen Daten möglich ist, ist nicht gewährleistet, dass die Daten Informationen über beispielsweise von Patienten berichtete Ergebnisse (wie Messungen der Lebensqualität) enthalten, die für das HTA von Interesse sein könnten. Diese praktischen Probleme in Verbindung mit den bereits erwähnten konzeptionellen Fragen machen die Validierung möglicher Surrogatendpunkte immer noch zu einer anspruchsvollen Aufgabe.

© Luc Viatour
Tomasz Burzykowski, ist Professor für Biostatistik und statistische Bioinformatik am Data Science Institute der Universität Hasselt (Belgien). Außerdem ist er Vizepräsident für Forschung beim International Drug Development Institute (IDDI), einem Auftragsforschungsinstitut, das Dienstleistungen für klinische Studien anbietet. Er hatte Gastprofessuren am Karolinska-Institut (Schweden), an der Technischen Universität Warschau (Polen) und an der Medizinischen Universität Bialystok (Polen). In den Jahren 2023-2024 war er Präsident der Internationalen Gesellschaft für klinische Biostatistik.
Literatur
1 Buyse M, Molenberghs G, Burzykowski T, Renard D, Geys H (2000): The validation of surrogate endpoints in meta-analyses of randomized experiments. (Die Validierung von Surrogat-Endpunkten in Meta-Analysen randomisierter Experimente.) Biostatistics 1: 49-68.
2 Buyse M, Burzykowski T, Carroll K, Michiels S, Sargent D, Miller LL, Elfring GL, Pignon JP, Piedbois P (2007): Progression-free survival is a surrogate for survival in advanced colorectal cancer. (Progressionsfreies Überleben als Surrogat für das Gesamtüberleben bei fortgeschrittenem kolorektalem Karzinom.) Journal of Clinical Oncology 25: 5218-5224.
3 Buyse M (2016) Introduction. In: Applied Surrogate Endpoint Evaluation Methods with SAS and R (Angewandte Methoden der Surrogatendpunktevaluation mit SAS und R) (Alonso A, Bigirumurame T, Burzykowski T, Buyse M, Molenberghs G, Muchene L, Perualila NJ, Shkedy Z, Van der Elst W), Chapman & Hall/CRC (ISBN 978-1-4822-4936-1).
4 Buyse M, Saad ED, Burzykowski T, Regan MM, Sweeney CS (2022): Surrogacy beyond prognosis: the importance of „trial level“ surrogacy. (Surrogatparameter jenseits der Prognose: Die Bedeutung der Surrogatvalidität auf Studienebene.) The Oncologist 5: 266 271.
5 HTA CG (2024) https://health.ec.europa.eu/publications/guidance-outcomes-joint-clinical-assessments_en.
6 Oba K, Paoletti X, Alberts S, Bang YJ, Benedetti J, Bleiberg H, Catalano P, Lordick F, Michiels S, Morita S, Ohashi Y, Pignon JP, Rougier P, Sasako M, Sakamoto J, Sargent D, Shitara K, Van Cutsem E, Buyse M, Burzykowski T im Namen der GASTRIC-Gruppe (2013): Disease-free survival as a surrogate for overall survival in adjuvant trials of gastric cancer: a meta-analysis. (Krankheitsfreies Überleben als Surrogat für das Gesamtüberleben in adjuvanten Studien zum Magenkarzinom: Eine Meta-Analyse.) Journal of the National Cancer Institute 5: 1600-1607.
7 Paoletti X, Oba K, Bang YJ, Bleiberg H, Boku N, Bouche O, Catalano P, Fuse N, Michiels S, Moehler M, Morita S, Ohashi Y, Ohtsu A, Roth A, Rougier P, Sakamoto J, Sargent D, Sasako M, Shitara K, Thuss-Patience E, Van Cutsem E, Burzykowski T, Buyse M im Namen der GASTRIC-Gruppe (2013). Progression-free survival as a surrogate for overall survival in patients with advanced/recurrent gastric cancer: a meta-analysis. (Progressionsfreies Überleben als Surrogat für das Gesamtüberleben bei Patienten mit fortgeschrittenem/rezidiviertem Magenkarzinom: Eine Meta-Analyse.) Journal of the National Cancer Institute 5: 1608-1612.
8 Shi Q, de Gramont A, Grothey A, Zalcberg J, Chibaudel B, Schmoll H-J, Seymour MT, Adams R, Saltz L, Goldberg RM, Punt CJA, Douillard J-Y, Hecht JR, Hurwitz H, Diaz-Rubio E, Proschen R, Tebbutt NC, Fuchs C, Souglakos J, Falcone A, Tournigand C, Kabbinavar FF, Heinemann V, Van Cutsem E, Bokemeyer C, Buyse M, Sargent DJ im Namen der Gruppe für Analyse und Forschung zu Krebserkrankungen des Verdauungssystems (ARCAD-Gruppe) (2014). Individual patient data analysis of progression-free versus overall survival as a first-line endpoint for metastatic colorectal cancer in modern randomized trials: Findings from 16,700 patients from the ARCAD database. (Individuelle Patientendatenanalyse von progressionsfreiem versus Gesamtüberleben als Erstlinienendpunkt für metastasierten kolorektalen Karzinom in modernen randomisierten Studien: Ergebnisse von 16.700 Patienten aus der ARCAD-Datenbank.) Journal of Clinical Oncology 33: 22 28.




