Welche Endpunkte sind patientenrelevant?
Studienendpunkte in der frühen Nutzenbewertung aus Sicht des IQWiG
Bei der frühen Nutzenbewertung ist die zentrale Frage, ob ein neues Arzneimittel im Vergleich zum bisherigen Therapiestandard einen patientenrelevanten Vorteil bietet. Ein solcher Vorteil kann auf Basis von patientenrelevanten Endpunkten oder validen Surrogaten abgeleitet werden. Das Problem ist: Daten zur Beantwortung dieser Frage fehlen weiterhin zu oft. Viel zu häufig liegen keine geeigneten Studien für die Bewertung vor. Wenn geeignete Studien vorliegen, sind dies in der Regel Zulassungsstudien, deren primäre Endpunkte oft nicht patientenrelevant sind bzw. nicht validierte Surrogatparameter enthalten.
Veröffentlicht:
© djama / stock.adobe.com
Die Patientenrelevanz ist fest in der frühen Nutzenbewertung verankert. Der Nutzen eines Arzneimittels wird gemäß der Arzneimittel-Nutzenverordnung1 definiert als „der patientenrelevante, therapeutische Effekt insbesondere hinsichtlich der Verbesserung des Gesundheitszustandes, der Verkürzung der Krankheitsdauer, der Verlängerung des Überlebens, der Verringerung von Nebenwirkungen oder einer Verbesserung der Lebensqualität. Der Zusatznutzen im Sinne dieser Verordnung ist ein Nutzen, der quantitativ oder qualitativ höher ist als der Nutzen, den die zweckmäßige Vergleichstherapie aufweist“ (Paragraf 2 Absatz 4 AM-NutzenV)1. Patientenrelevant ist entsprechend dem Methodenpapier des IQWiG2 „wie eine Patientin oder ein Patient fühlt, ihre oder seine Funktionen und Aktivitäten wahrnehmen kann oder ob sie oder er überlebt“.
Im Zentrum der Nutzenbewertung stehen demnach Endpunkte, welche von den Patientinnen und Patienten ganz unmittelbar wahrgenommen werden können. Patientenrelevante Endpunkte werden in der frühen Nutzenbewertung den vier Kategorien Mortalität, Morbidität, gesundheitsbezogene Lebensqualität und Nebenwirkungen zugeordnet. Davon abzugrenzen sind Endpunkte, die beispielsweise auf Bildgebung oder Laborbefunden beruhen und für Patientinnen und Patienten nicht spürbar sind. Immer wieder werden auch Änderungen der Darreichungsform als patientenrelevanter Vorteil per se vorgeschlagen. Ohne einen Nachweis, dass eine neue Darreichungsform patientenrelevante Endpunkte wie z. B. die gesundheitsbezogene Lebensqualität beeinflusst, kann ein solcher Vorteil weder gemäß SGB V noch aus der Definition der Patientenrelevanz des IQWiG abgeleitet werden. Nur in Ausnahmefällen, z. B. wenn an Stelle einer intrathekalen Gabe eine orale Gabe möglich ist,3 und damit eindeutig von einer Verringerung von Komplikationen der Medikamentengabe ausgegangen werden kann, kann ein patientenrelevanter Vorteil abgeleitet werden.
Hoher Stellenwert Patienten-berichteter Endpunkte
Bei Endpunkten zur Morbidität und Lebensqualität sind Patienten-berichtete Endpunkte (engl. Patient-Reported Outcomes, PROs) von großer Bedeutung, ihre Rolle in klinischen Studien wurde durch ihre Bedeutung im AMNOG-Verfahren gestärkt. Bei PROs beurteilen die Patientinnen und Patienten selbst, wie sich der Einsatz des neuen Medikamentes beispielsweise auf ihre Symptome oder ihre gesundheitsbezogene Lebensqualität auswirkt. Ohne die Erhebung von PROs ergibt sich nur ein unvollständiges Bild zum Nutzen und Schaden von neuen Arzneimitteln. Schon bei der Entwicklung von PRO-Instrumenten ist die Patienteneinbindung unerlässlich. Nur dies stellt sicher, dass alle aus Sicht der Patientin / des Patienten relevanten Aspekte verständlich und vollständig abgebildet sind.
PROs sind grundsätzlich gegenüber anthropometrischen Parametern, wie Körpergröße, als patientenrelevanter Endpunkt zu bevorzugen. Die Körpergröße (z-Score) wurde im Anwendungsgebiet Achondroplasie4 zwar als patientenrelevant eingestuft, es ist jedoch schwer abschätzbar, wie sich eine bestimmte Veränderung im Endpunkt Körpergröße (z-Score) letztendlich auf die Patientin bzw. den Patienten auswirkt, z. B. auf seine/ihre funktionellen Einschränkungen und Schmerzen. Für die Nutzenbewertung ließ sich deshalb der Zusatznutzen im Endpunkt Körpergröße (z-Score) nicht abschließend quantifizieren.
Auch bei Endpunkten zu Nebenwirkungen ist der Einsatz von PROs möglich, jedoch noch kein Standard. Zudem eignen sich nicht alle unerwünschten Ereignisse zur Erhebung mittels PROs, beispielsweise sind direkt beobachtbare/messbare Ereignisse (z. B. Netzhautriss) ungeeignet. Subjektiv empfundene Nebenwirkungen wie Übelkeit können hingegen sehr wohl mit PROs erhoben werden. Hierfür hat das National Cancer Institute (NCI) das PRO-Common Terminology Criteria for Adverse Events (PRO-CTCAE) System zur Bewertung von symptomatischer Toxizität bei Patientinnen und Patienten in onkologischen Studien entwickelt.5 Das System PRO-CTCAE wurde bereits in mehreren Nutzenbewertungen dem IQWiG vorgelegt, erstmals in A20-87 und A23-86. Jedoch waren die entsprechenden Daten nicht verwertbar, da zum einem keine detaillierte Begründung für die Auswahl der aus dem PRO-CTCAE System verwendeten symptomatischen UEs vorlag und zudem die Ergebnisse lediglich deskriptiv dargestellt wurden ohne Berücksichtigung unterschiedlicher Beobachtungsdauern.6,7
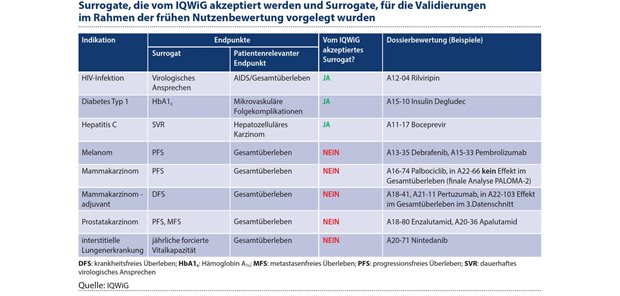
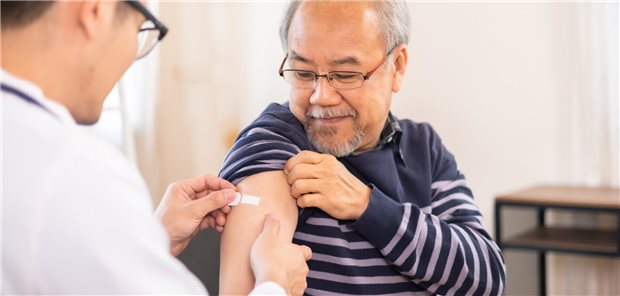
Tabelle 1: Bisher konnten die vorgelegten Validierungen oder Validierungsstudien überwiegend nicht dazu beitragen, die Eignung der jeweiligen Surrogatendpunkte zu zeigen.
© Springer Medizin Verlag
Nur wenige Surrogatvalidierungen vorgelegt
In frühen Nutzenbewertungen hat das IQWiG bisher drei Surrogatendpunkte als ausreichend valide Surrogate für jeweils unterschiedliche patientenrelevante Endpunkte akzeptiert: Virologisches Ansprechen als Surrogat für AIDS/Gesamtüberleben bei der HIV-Infektion, HbA1c-Wert als Surrogat für mikrovaskuläre Folgekomplikationen bei Diabetes Typ 1 und das anhaltende virologische Ansprechen (englisch Sustained Virological Response [SVR]) als Surrogat für die Vermeidung des Auftretens eines hepatozellulären Karzinoms bei Hepatitis C-Infektion.8-10 Insgesamt wurden dem IQWiG jedoch nur wenige Validierungen von Surrogaten für die frühe Nutzenbewertung vorgelegt, diese waren vornehmlich im onkologischen Bereich (siehe Tabelle 1).
Hier ist insbesondere das progressionsfreie Überleben (englisch progression free survival [PFS]) zu nennen, für das am häufigsten Surrogatvalidierungen vorgelegt wurden (für die Indikationen Melanom, Mammakarzinom und Prostatakarzinom11-15). Darüber hinaus wurden für das krankheitsfreie Überleben (englisch disease-free survival [DFS]) bei Mammakarzinom-adjuvant, das Metastasen-freie Überleben bei Prostatakarzinom und die jährliche forcierte Vitalkapazität bei interstitieller Lungenerkrankung jeweils Surrogatvalidierungen vorgelegt.15-18
Jedoch waren die vorgelegten Validierungen / Validierungsstudien nicht geeignet, die Eignung der jeweiligen Surrogatendpunkte für das Gesamtüberleben zu zeigen. Unabhängig von der Frage der Eignung als Surrogat für das Gesamtüberleben wurden einige Endpunkte bzw. Operationalisierungen, welche das Fortschreiten einer Krebserkrankung abbilden, als patientenrelevant eingestuft: so wurde die symptomatische Progression beim Prostatakarzinom, die über für den Patienten spürbare Symptome operationalisiert wurde, in zwei Nutzenbewertungen akzeptiert.15, 19 Auch Rezidive wurden grundsätzlich als patientenrelevanter Endpunkt in verschiedenen Nutzenbewertungen akzeptiert.16,17
Die Erhebung des Endpunkts Rezidive beruht zwar auf einer Bildgebung, jedoch wird es als Scheitern des kurativen Ansatzes gewertet, wenn der Tumor während oder nach einer (adjuvanten) Therapie mit kurativer Absicht wieder feststellbar ist. Dies stellt für die Patientinnen und Patienten ggf. den Übergang in ein nicht mehr heilbares Krankheitsstadium dar und ist damit unmittelbar patientenrelevant. Zudem ist das Scheitern des kurativen Therapieansatzes auch bei Patientinnen und Patienten relevant, die zu Studienbeginn nicht tumorfrei sind und wurde vom IQWiG als eigenständiger Endpunkt bei hämatoonkologischen Patientinnen und Patienten mit diffusem großzelligem B-Zell-Lymphom (DLBCL)20-22, aber auch bei Patientinnen und Patienten mit soliden Tumoren23,24 herangezogen.
Methodische Anforderungen für valide Surrogate
Surrogatvalidierungen sind grundsätzlich auf Basis von randomisiert kontrollierten Studien (RCTs) sowie in weiteren speziellen Situationen (wie sie bei der SVR gegeben waren) möglich. Erstere bedürfen in der Regel einer Metaanalyse von mehreren RCTs, in denen sowohl Effekte auf den Surrogatendpunkt als auch Effekte auf den interessierenden patientenrelevanten Endpunkt untersucht wurden. Anerkannte Validierungsverfahren sind korrelationsbasierte Verfahren wie die Betrachtung der Korrelation zwischen den Effekten auf Studienebene sowie der Surrogate Threshold Effect (STE).
Neben der verwendeten Methodik zur Surrogatvalidierung ist es dabei von elementarer Bedeutung, dass der zugrundeliegende Studienpool vollständig und geeignet ist. Die in den Nutzenbewertungen zu Pertuzumab (Mammakarzinom)16, 17 und Nintedanib (interstitielle Lungenerkrankung)18 vorgelegten Validierungsstudien zeigen, dass es prinzipiell möglich ist, eine Surrogatvalidierung gemäß der Anforderung des IQWiG durchzuführen. In dem Projekt zu Pertuzumab sollte das DFS und zu Nintedanib die jährliche forcierte Vitalkapazität je als geeignetes Surrogat für das Gesamtüberleben gezeigt werden. Bei Pertuzumab war der zugrunde gelegte Studienpool der Validierungsstudie nicht geeignet, da hier Studien ausgeschlossen wurden, die in dem in dieser Nutzenbewertung vorliegenden Anwendungsgebiet relevant gewesen wären. Bei Nintedanib war die methodische Durchführung der Validierung fehlerhaft, was zu einer Unterschätzung des STE führte. Nach selbst berechneter Korrektur zeigte sich, dass der Effekt auf das Surrogat nicht groß genug war, um einen Effekt auf das Gesamtüberleben abzuleiten.
Darüber hinaus gibt es spezielle Situationen, in denen ebenfalls eine Validität anerkannt werden kann.25 Dafür ist es erforderlich, dass der Zusammenhang zwischen dem patientenrelevanten Endpunkt und dem Surrogatendpunkt biologisch/medizinisch eindeutig plausibel ist und weitere Kriterien erfüllt sind. Ein Beispiel ist die SVR bei Patientinnen und Patienten mit chronischer Hepatitis-CInfektion, bei dem der Eintritt des Surrogatendpunkts zu einem deutlich reduzierten Risiko für das Auftreten von hepatozellulären Karzinomen führte. Zudem erreichte das Risiko bezüglich des eigentlichen Endpunkts ein minimales Niveau, nämlich das einer nicht erkrankten Population.10 Als Datengrundlage müssen in den speziellen Situationen Kohortenstudien vorliegen, die sich auf Personen unter Therapie beziehen und deren Nachbeobachtungszeit ausreichend lang ist, um das Risiko für das Eintreten des eigentlichen Endpunkts adäquat zu erfassen.
Nutzenbewertung und Therapieentscheidungen erfordern hinreichend sichere Daten
Problematisch ist aus Sicht des IQWiG, dass für die Zulassung neuer Arzneimittel von den Zulassungsbehörden häufig Surrogatendpunkte akzeptiert werden, die nicht ausreichend validiert sind und dass die Verwendung solcher Surrogatendpunkte über die letzten Jahrzehnte sowohl bei der Food and Drug Administration (FDA) als auch der Europäische Arzneimittel-Agentur (EMA) zugenommen hat.26-28 Für die (ggf. beschleunigte/bedingte) Zulassung wird oft die Position eingenommen, dass dies vertretbar sei und man die größere Aussageunsicherheit akzeptieren möchte, um ein neues Medikament schnell verfügbar zu machen.
Die Akzeptanz einer großen Aussageunsicherheit zum Zeitpunkt der Zulassung darf jedoch nicht dazu führen, dass niemals wirklich zuverlässige Daten generiert werden. Die Fragestellung der Nutzenbewertung und evidenzbasierte Therapieentscheidungen erfordern eine hinreichende Aussagesicherheit. Ziel der frühen Nutzenbewertung ist, diejenigen neuen Arzneimittel mit dem Urteil „Zusatznutzen belegt“ herauszufiltern, die hinreichend sicher einen Mehrwert für die Patientinnen und Patienten aufweisen und nicht nur „vielleicht“.
Ebenso erfordert eine evidenzbasierte medizinische Versorgung aussagekräftige Daten für gut begründete Therapieentscheidungen. Dafür braucht es aussagekräftige Endpunkte und in gewissen Fällen mehr bzw. bessere Surrogatvalidierungen. Des Weiteren trifft der oft geäußerte Vorwurf, dass in Leitlinien und Disease-Management-Programmen (DMP) beschriebene Therapieparameter von der Nutzenbewertung ignoriert werden, ebenfalls nicht den Kern des Problems: So legitimiert der in Leitlinie oder DMP empfohlene Einsatz eines Labor-Parameters zur Therapiesteuerung beim individuellen Patienten keinesfalls zwangsläufig seine Eignung als patientenrelevanter Endpunkt in einer klinischen Studie. Entscheidend für die Nutzenbewertung kann nur sein, ob man hinreichend sicher ist, dass sich ein Effekt im Surrogatendpunkt auch in einem Effekt im patientenrelevanten Endpunkt widerspiegeln wird.
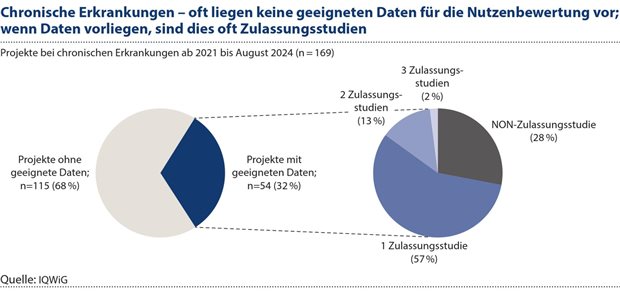
Abbildung 1: Von den 169 Nutzenbewertungen mit Bezug auf chronische Erkrankungen lagen im Zeitraum von Anfang 2021 bis Anfang August 2024 bei 68 Prozent (115) der Projekte keine geeigneten Daten vor. Problematisch waren dabei nicht primär die Endpunkte, sondern das Studiendesign.
© Springer Medizin Verlag
Datenlage bei chronischen Erkrankungen ist unverändert schlecht
Insbesondere im Bereich der chronischen Erkrankungen zeigt sich unverändert oft ein erheblicher Mangel an geeigneten Daten für die frühe Nutzenbewertung. Von 2021 bis Anfang August 2024 wurden vom IQWiG insgesamt 169 Nutzenbewertungen im Bereich chronischer Erkrankungen durchgeführt. Bei 68 Prozent (115) der Projekte lagen keine geeigneten Daten vor (siehe Abbildung 1).
Problem sind hier zunächst nicht die Endpunkte, sondern vielmehr das Studiendesign. Auch wenn es sich in der Mehrzahl der Studien um RCTs handelte, sind die Daten für die Nutzenbewertung häufig nicht geeignet, da diese RCTs auf einem Vergleich gegenüber einem Placebo oder einer nicht adäquaten Therapie im Vergleichsarm basieren, anstatt auf einem direkten Vergleich mit der aktuellen Standardtherapie. In anderen Fällen findet sich gar kein Vergleich (1-armige Studien). Daten solcher Studien sind für die Nutzenbewertung in der Regel nicht geeignet. Bereits 2019 wurde bemängelt, dass für die Nutzenbewertung häufig keine geeigneten Daten verfügbar sind.29 Leider ist – hier mit Blick auf die chronischen Erkrankungen – diesbezüglich keine positive Entwicklung zu sehen. Die Ursachen für diese Stagnation und mögliche Ansatzpunkte zur Veränderung (gezielter Einsatz positiver oder negativer [An-]Reize) sollten diskutiert werden.
In den 54 (32 Prozent) Nutzenbewertungen von 2021 bis Anfang August 2024 in denen geeignete Daten für die Nutzenbewertung vorlagen, wurde in über 70 Prozent der Bewertungen auf Zulassungsstudien zurückgegriffen. In der Mehrzahl dieser Fälle lag jeweils nur eine Zulassungsstudie für die Nutzenbewertung vor. Für 15 (28 Prozent) der Nutzenbewertungen wurden Nicht-Zulassungsstudien (Abbildung 1) herangezogen. Insgesamt war in nur etwa einem Viertel der eingeschlossenen Studien der primäre Studienendpunkt uneingeschränkt patientenrelevant. Bei über 40 Prozent der eingeschlossenen Studien war der primäre Endpunkt nicht patientenrelevant, weil dieser, wie oben bereits für Zulassungsstudien beschrieben, beispielsweise auf einem (nicht ausreichend validierten) Surrogatendpunkt basierte (z. B. Änderung des HbA1c-Werts bei Diabetes Typ 2-, oder der eGFR Slope bei Morbus Fabry Patientinnen und Patienten, siehe Abbildung 2).
Zur eGFR ist anzumerken, dass Änderungen der eGFR nur dann patientenrelevant sind, wenn hinreichend sicher ist, dass die eGFR in einen für die Patienten / den Patienten spürbaren Bereich abfällt. Dies war in einem der beiden Addenda zu Finerenon30 erstmals der Fall. Der kombinierte Endpunkt der vorgelegten Studien zur renalen Morbidität umfasste die Einzelkomponenten Nierenversagen (definiert als bestätigt anhaltende Abnahme der eGFR auf < 15 ml/min/1,73 m2 oder Nierenerkrankung im Endstadium), eGFR-Abnahme ≥ 57 Prozent und renal bedingter Tod. Aufgrund der mittleren eGFR-Ausgangswerte (ca. 43 ml/min/1,73 m2) der Patientinnen und Patienten konnte in der vorliegenden Datensituation von einer hinreichenden Patientenrelevanz der Komponente eGFR-Abnahme ≥ 57 Prozent ausgegangen und der kombinierte Endpunkt herangezogen werden.
In 30 Prozent der eingeschlossenen Studien konnte der primäre Endpunkt nur mit Einschränkungen herangezogen werden (z. B.: Veränderung der durchschnittlichen monatlichen Migränetage gegenüber Baseline vs. Migränetage/Monat Reduktion um 50 Prozent oder nur einzelne Komponenten eines kombinierten Endpunkts wurden herangezogen, siehe Abbildung 2). Die Operationalisierung eines Endpunkts kann somit auch entscheidend dafür sein, ob ein Endpunkt als patientenrelevant eingeschätzt wird oder nicht.
Es zeigt sich also, dass die Tatsache, dass ein Endpunkt in (Zulassungs-)Studien untersucht wurde, nicht zwangsläufig bedeutet, dass es sich um einen patientenrelevanten Endpunkt handelt. Statt „Studienendpunkt–> relevant“ sollte, wie bereits 2016 von Thomas Kaiser vorgeschlagen,31 besser gelten „relevanter Endpunkt–> Studienendpunkt“? Grundsätzlich sollten HTA-Entscheidungen die Verwendung von Studienendpunkten, die eine hohe Unsicherheit mit sich bringen, nicht incentivieren und stattdessen vielmehr die Untersuchung von aussagekräftigen, patientenrelevanten Endpunkten belohnen.29
Die Frage der Patientenrelevanz des primären Endpunkts bzw. dessen Operationalisierung ist jedoch nur selten unmittelbar fazitrelevant hinsichtlich der Frage „Besteht ein Zusatznutzen: ja oder nein?“. Lediglich in sechs Projekten (11 Prozent) von 2021 bis Anfang August 2024 wurde kein Zusatznutzen abgeleitet, obwohl sich auf Basis der vorgelegten Studien ein Vorteil für die Intervention beim primären (aber nicht patientenrelevanten) Endpunkt zeigte (z. B. Änderung des HbA1c-Werts bei Typ 2-Diabetes). Meist gibt es aber weitere relevante Endpunkte die einen Zusatznutzen zeigten (dies war in 24 Projekten [44 Prozent] der Fall). Ein Beispiel ist die Bewertung von Risankizumab, in der zwar der primäre Endpunkt (endoskopische Remission) nicht akzeptiert wurde, sich aber positive Effekte im Inflammatory Bowel Disease Questionnaire (IBDQ; Gesamtscore und Subscore-Darmsymptome) und Short Form-36 (SF-36) zeigten.32
In anderen Bewertungen zeigten sich neben positiven Effekten auch negative Effekte, die in der Gesamtschau zum Urteil „kein Zusatznutzen“ führten (zwei Projekte [4 Prozent]). Bei sieben Projekten (13 Prozent) zeigte der primäre (nicht patientenrelevante) Endpunkt keinen Effekt und die Ablehnung hatte daher keinen Einfluss auf das Fazit der Nutzenbewertung (siehe auch Abbildung 3). Bei diesen Studien handelte es sich um Nichtunterlegenheitsstudien. Problematisch ist jedoch, wenn in diesen Fällen de facto keine aussagekräftigen Endpunkte zur Mortalität, Morbidität oder Lebensqualität, d. h. zu Nutzenendpunkten, vorliegen. Dies war beispielsweise bei Vadadustat der Fall33, aber auch in den neuesten Diabetesbewertungen (Typ 2) zeigt sich, dass die Studien weiterhin nicht auf die Therapieziele ausgerichtet sind.34
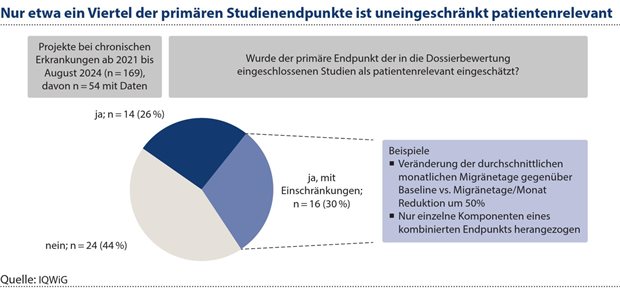
Abbildung 2: Die Operationalisierung eines Endpunkts kann auch entscheidend dafür sein, ob ein Endpunkt als patientenrelevant eingeschätzt wird oder nicht. Dass ein Endpunkt in (Zulassungs-)Studien untersucht wurde, bedeutet nicht zwangsläufig, dass es sich um einen patientenrelevanten Endpunkt handelt.
© Springer Medizin Verlag
Verbesserungen bei PRO-Analysen notwendig
Die Datenqualität von PROs für die Nutzenbewertung ist oft nicht ausreichend, so dass nur ein Teil der vorgelegten PRO-Analysen letztlich für die Nutzenbewertung geeignet ist.35 Ein weiteres häufiges Problem ist, dass die PROs zu kurz erhoben werden. Der Grund ist vermutlich, dass die für die Nutzenbewertung vorgelegten Studien stark auf die Zulassung zugeschnitten sind. So werden die PROs z. B. nur bis zur Progression der Erkrankung erfasst. Aber für die Betroffenen sind die Symptome und Lebensqualität selbstverständlich auch nach einer Verschlechterung der Erkrankung relevant. Ob es der Patientin oder dem Patienten mit der zu bewertenden Intervention langfristig besser oder schlechter geht als mit der Vergleichsbehandlung lässt sich nur beurteilen, wenn die entsprechenden PROs über den Progress hinaus erhoben werden.36
Von besonderer Bedeutung ist zudem, dass im Erhebungszeitraum die PROs vollständig erhoben werden. So führen zu geringe Rücklaufquoten der entsprechenden Fragebögen oft dazu, dass die Daten für die Nutzenbewertung nicht herangezogen werden können. Auch in einer Diskussionsrunde verschiedener Interessenvertreter wurde seitens der Patientenvertretungen geäußert, dass Betroffene durchaus willens sind, Zeit in die PRO-Erfassung zu investieren, wenn man ihnen konkret erläutert, wozu ihre Angaben benötigt werden. Das zeigt: Eine längere Erhebung solcher Zielgrößen ist grundsätzlich machbar – und läuft den Interessen der Betroffenen keineswegs zuwider.37
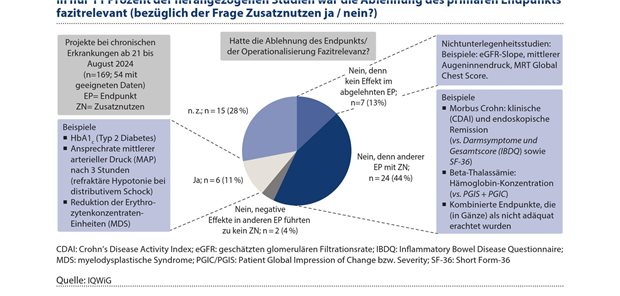
Abbildung 3: In der überwiegenden Zahl der Bewertungen ist die Ablehnung des primären Studienendpunktes aufgrund seiner nicht-gegebenen Patientenrelevanz nicht fazitrelevant für die Frage nach dem Zusatznutzen (ja oder nein?)
© Springer Medizin Verlag
Die Analyse bzw. Operationalisierung von PRO-Endpunkte muss im Einzelfall sorgfältig diskutiert werden, da zahlreiche Aspekte die Aussagekraft der Ergebnisse beeinflussen können. So ist beispielsweise je nach Indikation und Therapieziel einmal die (dauerhafte) Verbesserung, ein anderes Mal die Verschlechterung primär relevant. Betrachtet man stetige Auswertungen oder Responderanalysen zu einem bestimmten Auswertungszeitpunkt? Welcher Zeitpunkt wäre am besten geeignet für eine Responder- analyse?38 Welches Responsekriterium ist geeignet, eine spürbare Veränderung anzuzeigen? Für die Frage nach dem Responsekriterium hat sich die vom IQWiG vorgeschlagene patientenindividuelle Änderung von 15 Prozent der Spannweite des Erhebungsinstruments als praxistauglich erwiesen.39 Ziel dieses vom IQWiG entwickelten Ansatzes war es auch, Klarheit für die Hersteller zu schaffen und ergebnisgesteuerte Berichterstattung zu verhindern. Seit ihrer Einführung wird diese Responseschwelle regelmäßig von Herstellern in Studien bzw. Dossiers angewendet.
Fazit
IQWiG-Grundsätze sind unverändert: Patientenrelevanz ist das Paradigma der Nutzenbewertung.
Stand zu Surrogaten: wenige vorgelegte Validierungen, hauptsächlich im onkologischen Bereich. Zahlreiche Veröffentlichung der letzten Jahre zeigen: Zulassungsbehörden akzeptieren Surrogate, deren Validität nicht hinreichend gezeigt ist – mehr Validierungen (da, wo nötig) wünschenswert.
Statt „Studienendpunkt–> relevant“ sollte gelten „relevanter Endpunkt–> Studienendpunkt“
Verbesserungen bei PRO-Analysen notwendig:
- grundsätzliche methodische Qualität (Vollständigkeit und Qualität der Daten) & Dauer der PRO-Erhebung oft verbesserungswürdig (z. B. über Progress hinaus).
- Sinnhaftigkeit von Analysen muss im Einzelfall diskutiert werden (z. B. Symptomlast, [dauerhafte] Verbesserung/Verschlechterung; Umgang mit „intercurrent events“; betrachteter Zeitpunkt).
- Insgesamt sind (noch) mehr hochwertige Daten zu PROs notwendig.

© Privat
Dr. Daniela Preukschat, seit 2021 Bereichsleiterin im Ressort Arzneimittelbewertung (Bereich chronische Erkrankungen) im IQWiG. Nach dem Studium der Biologie sowie der Sportwissenschaften promovierte sie 2013 am Institut für Genetik der Universität zu Köln. Anschließend arbeitete sie zunächst im Bereich Evidenzbasierte Medizin des MDS (Medizinischer Dienst des Spitzenverbandes Bund der Krankenkassen e.V., Essen) und kam 2016 zum IQWiG.

© Privat
Dr. Sebastian Meller, seit 2021 wissenschaftlicher Mitarbeiter im Ressort Arzneimittelbewertung im IQWiG. Nach dem Studium der Biologie an der Universität zu Köln und anschließender Promotion im Fachbereich Biomedizin an der Universitätsklinik Bonn arbeitete er mehrere Jahre als Projektmanager am Zentrum für Klinische Studien Köln.
Literatur
1 Bundesministerium für Gesundheit (2023) Verordnung über die Nutzenbewertung von Arzneimitteln nach § 35a Absatz 1 SGB V für Erstattungsvereinbarungen nach § 130b SGB V (Arzneimittel-Nutzenbewertungsverordnung - AM-NutzenV). https://go.sn.pub/f5cp5w. Accessed 09.10.2023.
2 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2023) Allgemeine Methoden; Version 7.0. https://go.sn.pub/mkwigq. Accessed 06.10.2023.
3 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2021) Risdiplam (spinale Muskelatrophie) – Nutzenbewertung gemäß § 35a SGB V; Dossierbewertung. https://go.sn.pub/doprfg. Accessed 11.07.2023.
4 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2024) Vosoritid (Achondroplasie); Addendum zum Projekt A23-92 (Dossierbewertung). https://doi.org/10.60584/A24-08. Accessed 23.02.2024.
5 Institute NC Patient-Reported Outcomes version of the Common Terminology Criteria for Adverse Events (PRO-CTCAE). https://go.sn.pub/n7lwyc. Accessed 07.10.2024.
6 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2020) Durvalumab (kleinzelliges Lungenkarzinom) – Nutzenbewertung gemäß § 35a SGB V; Dossierbewertung. https://go.sn.pub/90yg37. Accessed 11.07.2023.
7 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2023) Sacituzumab govitecan (Mammakarzinom); Nutzenbewertung gemäß § 35a SGB V; Dossierbewertung. https://doi.org/10.60584/A23-86. Accessed 17.11.2023.
8 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2012) Rilpivirin – Nutzenbewertung gemäß § 35a SGB V; Dossierbewertung. https://go.sn.pub/zphzud. Accessed 11.07.2023.
9 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2015) Insulin degludec (neues Anwendungsgebiet) – Nutzenbewertung gemäß § 35a SGB V; Dossierbewertung. https://go.sn.pub/3lai7e. Accessed 11.07.2023.
10 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2011) Boceprevir – Nutzenbewertung gemäß § 35a SGB V; Dossierbewertung. https://go.sn.pub/0605wp. Accessed 11.07.2023.
11 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2013) Dabrafenib – Nutzenbewertung gemäß § 35a SGB V; Dossierbewertung. https://go.sn.pub/qnv9l4. Accessed 11.07.2023.
12 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2015) Pembrolizumab – Nutzenbewertung gemäß § 35a SGB V; Dossierbewertung. https://go.sn.pub/0lfwif. Accessed 11.07.2023.
13 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2017) Palbociclib (Mammakarzinom) – Nutzenbewertung gemäß § 35a SGB V; Dossierbewertung. https://go.sn.pub/0r0kkc.. Accessed 11.07.2023.
14 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2017) Ribociclib (Mammakarzinom) – Nutzenbewertung gemäß § 35a SGB V; Dossierbewertung. https://go.sn.pub/kqadrk. Accessed 11.07.2023.
15 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2020) Apalutamid (Prostatakarzinom) – Nutzenbewertung gemäß § 35a SGB V (Ablauf Befristung); Dossierbewertung. https://go.sn.pub/7dbyze. Accessed 11.07.2023.
16 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2018) Pertuzumab (Mammakarzinom) – Nutzenbewertung gemäß § 35a SGB V; Dossierbewertung. https://go.sn.pub/nnvllq. Accessed 11.07.2023.
17 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2021) Pertuzumab/Trastuzumab (Mammakarzinom, adjuvant) – Nutzenbewertung gemäß § 35a SGB V; Dossierbewertung. https://go.sn.pub/x6kivq. Accessed 11.07.2023.
18 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2020) Nintedanib (andere chronische progredient fibrosierende interstitielle Lungenerkrankungen) – Nutzenbewertung gemäß § 35a SGB V; Dossierbewertung. https://go.sn.pub/4bj058. Accessed 11.07.2023.
19 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2024) Niraparib/Abirateronacetat (Prostatakarzinom); Addendum zum Projekt A23-107 (Dossierbewertung). https://go.sn.pub/g13v0o. Accessed 06.05.2024.
20 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2023) Lisocabtagen maraleucel (DLBCL, HGBL, PMBCL und FL3B, Zweitlinie); Nutzenbewertung gemäß § 35a SGB V; Dossierbewertung. https://go.sn.pub/uz4974. Accessed 16.09.2023.
21 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2023) Axicabtagen-Ciloleucel (DLBCL und HGBL, Zweitlinie); Nutzenbewertung gemäß § 35a SGB V; Dossierbewertung. https://go.sn.pub/w6w8p2. Accessed 10.10.2023.
22 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2024) Polatuzumab Vedotin (Kombination mit Rituximab, Cyclophosphamid, Doxorubicin und Prednison; bisher unbehandeltes DLBCL); Nutzenbewertung gemäß § 35a SGB V; Dossierbewertung. https://go.sn.pub/n4pkoh. Accessed 02.04.2024.
23 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2024) Nivolumab (NSCLC, neoadjuvant); Addendum zum Projekt A23-74 (Dossierbewertung). https://go.sn.pub/81yl50. Accessed 01.02.2024.
24 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2022) Pembrolizumab (Mammakarzinom) – Nutzenbewertung gemäß § 35a SGB V; Dossierbewertung. https://go.sn.pub/6f2qkt. Accessed 11.07.2023.
25 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2025) [A24-61] Wissenschaftliche Ausarbeitung zu klinischen Studien im Therapiegebiet Wundbehandlung. https://go.sn.pub/t18565. Accessed 07.01.2025.
26 Schuster Bruce C, Brhlikova P, Heath J, McGettigan P (2019) The use of validated and nonvalidated surrogate endpoints in two European Medicines Agency expedited approval pathways: A cross-sectional study of products authorised 2011-2018. PLoS Med 16(9):e1002873. doi:10.1371/journal.pmed.1002873.
27 Gyawali B, Hey SP, Kesselheim AS (2020) Evaluating the evidence behind the surrogate measures included in the FDA’s table of surrogate endpoints as supporting approval of cancer drugs. EClinicalMedicine 21:100332. doi:10.1016/j.eclinm.2020.100332.
28 Wallach JD, Yoon S, Doernberg H (2024) Associations Between Surrogate Markers and Clinical Outcomes for Nononcologic Chronic Disease Treatments. JAMA 331(19):1646-1654. doi:10.1001/jama.2024.4175.
29 Wieseler B, McGauran N, Kaiser T (2019) New drugs: where did we go wrong and what can we do better? BMJ 366:l4340. doi:10.1136/bmj.l4340.
30 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2023) Finerenon (Niereninsuffizienz, Stadium 3 und 4); Addendum zum Projekt A23-15 (Dossierbewertung). https://go.sn.pub/qmqozn. Accessed 23.08.2023.
31 Thomas Kaiser; Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2016) Klinisch relevante Studienendpunkte und Surrogate bei der frühen Nutzenbewertung. Interdisziplinäre Plattform zur Nutzenbewertung Heft 2 Januar 2016
32 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2023) Risankizumab (Morbus Crohn); Addendum zum Projekt A22-133 (Dossierbewertung). https://go.sn.pub/42elj9. Accessed 11.07.2023.
33 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2024) Vadadustat bei symptomatischer Anämie infolge chronischer Nierenerkrankung: Chance vertan. https://go.sn.pub/a2uk9c.
34 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2024) Insulin icodec (Diabetes mellitus Typ 2) – Nutzenbewertung gemäß § 35a SGB V. https://go.sn.pub/byfekc.
35 Kramer L, Moos M, Thaa B (2024) Health-related quality of life (HRQoL) in German early benefit assessment: The importance of disease-specific instruments. Z Evid Fortbild Qual Gesundhwes 186:1-9. doi:10.1016/j.zefq.2024.02.003.
36 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2022) Kritik an Studienplanung: Patientenberichtete Endpunkte oft viel zu kurz erhoben. https://go.sn.pub/em0o9l.
37 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2023) Langfristige Erhebung patientenberichteter Endpunkte in onkologischen Studien: wichtig und machbar. https://go.sn.pub/bdb35h.
38 Pe M, Alanya A, Falk RS (2023) Setting International Standards in Analyzing Patient-Reported Outcomes and Quality of Life Endpoints in Cancer Clinical Trials-Innovative Medicines Initiative (SISAQOL-IMI): stakeholder views, objectives, and procedures. Lancet Oncol 24(6):e270-e283. doi:10.1016/S1470-2045(23)00157-2.
39 Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (2021) Klinische Relevanz patientenberichteter Endpunkte: Neuer Schwellenwert erweist sich als praxistauglich. https://go.sn.pub/jmstw4.