Unternehmensporträt
Partner in der Immunologie für mehr Lebensqualität
© Biophoto Associates / Science Photo Library
Janssen erforscht und entwickelt seit über fünf Jahrzehnten innovative Arzneimittel. Ein Meilenstein im Bereich der Immunologie ist die Entwicklung des Biologikums Ustekinumab, das seit 2013 zur Therapie der Psoriasis-Arthritis zugelassen ist. Bei der Entwicklung innovativer Medikamente setzt das Unternehmen auf Kooperationen. So wurden in den letzten Jahren von Johnson & Johnson Innovation mehr als 300 strategische Partnerschaften mit Life-Science-Innovatoren geschlossen. Jedes zweite Produkt geht schon heute aus einer Kooperation hervor. Neben innovativen Medikamenten bietet das Unternehmen den Patienten auch ganzheitliche Versorgungskonzepte an, um die Therapietreue, die Lebensqualität und die Anwendungssicherheit im Alltag zu fördern.

© Janssen
Das Unternehmen
Als Teil des Gesundheitskonzerns Johnson & Johnson gehört Janssen zu den international führenden forschenden Pharmaunternehmen. Der Arzneimittelhersteller beschäftigt weltweit mehr als 40.000 Mitarbeiter, davon über 800 in Deutschland. Damit ist Janssen hierzulande – und auch weltweit - das fünftgrößte Pharmaunternehmen. Übergeordneter Anspruch aller unternehmerischen Aktivitäten ist es, Patienten trotz lebensbedrohlicher oder chronischer Krankheit einen lebenswerten Alltag zu ermöglichen. Forschungsschwerpunkte sind neben der Immunologie die Bereiche Onkologie, Infektiologie und Psychiatrie. 4,7 Mio. Menschen wurden 2016 mit den Präparaten von Janssen in Deutschland behandelt. Elf Wirkstoffe des Unternehmens hat die Weltgesundheitsorganisation auf die Liste der unverzichtbaren Arzneimittel gesetzt.

© Janssen
So beschrieb der Gründer von Janssen, der belgische Chemiker Dr. Paul Janssen, was ihn selbst zu medizinischer Pionierarbeit antrieb. In dieser Tradition steht das Unternehmen seit seiner Gründung 1953: Wenn es um das Thema Gesundheit geht, gibt es keine Zeit zu verlieren.
Rund 17 Millionen Euro täglich investierte Janssen im letzten Jahr weltweit in Forschung und Entwicklung. Dabei setzt das Unternehmen nicht allein auf die eigene Innovationskraft. Janssen ist Teil eines weltweiten Innovationsnetzwerks. In den vier Innovationszentren des Mutterkonzerns – in Boston, Menlo Park (USA), London (UK) und Shanghai (China) - werden gezielt Partnerschaften mit Biotech-Unternehmen, Hochschulen und Partner-Organisationen geschmiedet. Junge Unternehmen finden zudem in den JLABS und dem Inkubator JLINX die benötigten Forschungsbedingungen und Anschluss an das internationale Forschungsnetzwerk. So werden neue Lösungen für Patienten schneller verfügbar.
Starke Vernetzung für besseren Therapieerfolg
Damit Patienten alltägliche und besondere Momente wieder so erleben können, wie es vor der Diagnose für sie selbstverständlich war, setzt Janssen nicht allein auf Medikamente. Seit über zehn Jahren werden innovative, integrierte Gesundheitslösungen für den gesamten Behandlungspfad entwickelt – von der Diagnose bis zur Rückkehr in den Alltag. Damit Ärzte die Therapien noch wirksamer umsetzen, die Patienten individueller beraten und ihre Ressourcen effizienter einsetzen können. Dazu hat das Unternehmen den Bereich „Health Outcome Management“ geschaffen und steht darüber im Austausch mit Partnern wie Ärzten, Apothekern, Patientenorganisationen, Technologieunternehmen und Krankenhäusern.
Durch eine enge Vernetzung in und unter den Facharztgruppen sollen zudem die frühe Diagnose und die rechtzeitige Therapieeinleitung forciert werden. Die Behandlung von Komorbiditäten im interdisziplinären Austausch von Allgemeinmedizinern, Dermatologen, Rheumatologen oder Gastroenterologen ist ein wichtiger Schwerpunkt.
Janssen in der Rheumatologie
Der Bereich Immunologie mit den Fachgebieten Dermatologie, Rheumatologie und Gastroenterologie wird stetig ausgebaut. Ein Meilenstein ist das Biologikum Ustekinumab (Stelara®). Der IL-12/23-Inhibitor wurde zunächst zur Behandlung der Plaque-Psoriasis bei Erwachsenen und 2013 auch für die aktive Psoriasis-Arthritis (PsA) zugelassen. Seit 2015 ist es auch für Kinder und Jugendliche mit Plaque-Psoriasis ab einem Alter von 12 Jahren zugänglich. Im November 2016 wurde die Zulassung um die Therapie erwachsener Patienten mit mittelschwerem bis schwerem aktiven Morbus Crohn erweitert.
Global bietet das Unternehmen Patienten und Rheumatologen einige wichtige Therapieoptionen für die rheumatoide Arthritis (RA) und weitere rheumatologische Erkrankungen. Bereits 1998 wurde Infliximab, ein monoklonaler Antikörper gegen Tumornekrosefaktor(TNF)-α, von Centocor Inc. (jetzt: Janssen Biotech, Inc.) entwickelt, der mittlerweile für die Indikationen RA, ankylosierende Spondylitis (AS) und PsA verfügbar ist. Mit Golimumab folgte 2009 eine weitere Entwicklung, die in den gleichen Indikationen zugelassen ist. In der Rheumatologie entwickelt Janssen weitere innovative Therapien für Patienten mit RA (Abb. 1).
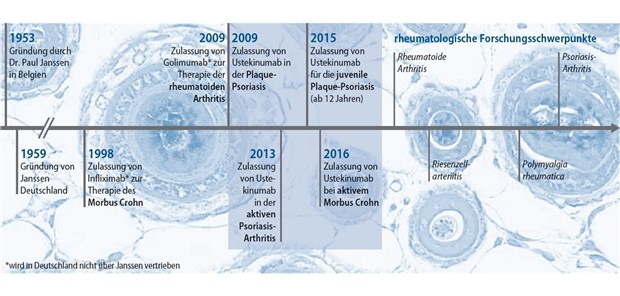
Abb. 1: Meilensteine der Therapie von entzündlichen Erkrankungen (Quelle: Janssen)
© Grafik: Springer Medizin Verlag GmbH
Interleukin-12/23-Inhibitor Ustekinumab
Ustekinumab ist ein rein humaner, monoklonaler Antikörper, der sich gegen die Untereinheit p40 der Zytokine Interleukin (IL)-12 und IL-23 richtet [1]. IL-12 ist für die Differenzierung von TH1-Zellen und IL-23 für das Überleben von TH17-Zellen nötig [2–4]. Die TH17-Zellen produzieren u.a. die Effektor-Zytokine IL-17 und IL-22. Durch die Hemmung von IL-23 sinkt die Zahl der TH17-Zellen. Damit werden weniger inflammatorische Zytokine freigesetzt, sodass die Entzündungsprozesse gedrosselt werden [5]. Der IL-12/23-Hemmer greift damit an einem Hauptschalter bei der Entstehung von TH17-Zellen ein [1].
Interdisziplinäres Fachforum zur Entzündungsmedizin
Mit dem „Inflammation Summit“ bietet Janssen ein ganzheitliches und nachhaltiges Fortbildungskonzept für Dermatologie, Rheumatologie und Gastroenterologie. Da Erkrankungen aus diesen drei Bereichen auch gleichzeitig auftreten können, ist eine ganzheitliche Betrachtung der Patienten wichtig für eine langfristig erfolgreiche Therapie. Die zertifizierte Fortbildungsveranstaltung unter der Federführung eines wissenschaftlichen Beirates soll die interdisziplinäre Zusammenarbeit und den Erfahrungsaustausch fördern. Dabei werden die Gemeinsamkeiten und Unterschiede von Plaque-Psoriasis, PsA und Morbus Crohn beleuchtet. Die Themen werden von je einem Vertreter der drei Indikationen präsentiert. In der gemeinsamen Diskussion geht es vor allem darum, sich über den Umgang mit Problemen in der Patientenversorgung auszutauschen und voneinander zu lernen. Neben regionalen Folgeveranstaltungen im Laufe des Jahres findet im Februar 2018 die nächste nationale Veranstaltung statt.
Ustekinumab ist in der Langzeittherapie erwachsener Patienten mit aktiver PsA gut wirksam und verträglich. Die Analyse der Follow-up-Phase ergab unter fortgesetzter Therapie mit Ustekinumab eine anhaltend reduzierte Gelenksymptomatik. Während der zweijährigen Nachbeobachtung blieb das günstige Verträglichkeitsprofil erhalten [6]. Ustekinumab ist auch nach mehreren vorausgegangenen Anti-TNF-α-Therapien wirksam, wie die Ein-Jahres-Daten der Phase-III-Studie PSUMMIT-2 zeigen [7]. Die Daten deuten darauf hin, dass der größte therapeutische Nutzen bei Biologika-naiven PsA-Patienten und bei Patienten mit nur einer Anti-TNF-α-Vortherapie erreicht werden kann [7].
Daten des amerikanischen Registers PSOLAR (PSOriasis Longitudinal Assessment and Registry) zufolge bewährt sich Ustekinumab auch im klinischen Alltag. In einer Subgruppenanalyse wurde die Therapieverweildauer von Patienten mit Psoriasis und einer vom Rheumatologen diagnostizierten PsA untersucht, die von einem TNF-α-Blocker entweder auf einen anderen TNF-α-Blocker oder auf Ustekinumab umgestellt wurden. 79,5% der auf Ustekinumab umgestellten PsA-Patienten (n=63) behielten die Therapie vier Jahre lang bei. Die Gründe für einen Therapieabbruch oder -wechsel waren unter allen Biologika ähnlich [8].
Umfassender Therapieansatz in der RA erforderlich
Mit einer Prävalenz bis zu 1% der Bevölkerung sind etwa dreimal mehr Patienten an der RA erkrankt als an der PsA. Trotz zahlreicher Therapieoptionen erreichen jedoch nur wenige Patienten eine Remission. Um diesen „unmet medical Need“ zu decken, forscht Janssen in der RA an neuen Zielstrukturen.
Die chronisch-entzündliche RA kann in den Gelenken zu strukturellen Veränderungen der Knochen und des Knorpels führen und irreversible Schäden verursachen [9] (Abb. 2). Darüber hinaus kann die RA weitere Aspekte im Leben eines Patienten beeinträchtigen, darunter das seelische Wohlbefinden und die soziale Teilhabe [10].
Patienten unterstützen: Gewicht und Beweglichkeit im Blick
Zusammen mit der Universitäts-Hautklinik Kiel wurde das Online-Coaching-Tool „BeWegbereiter“ entwickelt, das Psoriasis-Patienten dabei unterstützen soll, ihr Körpergewicht dauerhaft zu reduzieren. Seit April 2016 steht ein Bewegungsmodul für Patienten mit Psoriasis-Arthritis zur Verfügung. Die Videos mit Gelenk- und Kräftigungsübungen hat die Deutsche Sporthochschule Köln sportwissenschaftlich evaluiert; in einem Trainingsplan können die Nutzer ihre Übungseinheiten dokumentieren. Der Schweregrad der Übungen passt sich anhand des Patienten-Feedbacks an die individuelle Leistungsfähigkeit an. Mittels Pause-Button kann das Training, z.B. bei einem Schub, ausgesetzt werden. Im März 2017 wurde das Unterstützungsprogramm noch einmal optimiert – es ist nun auch auf mobilen Geräten anwendbar und wurde persönlicher, anschaulicher sowie motivierender gestaltet. Den Zugangscode für die Erstanmeldung bekommt der Patient von seinem behandelnden Arzt. Weiterführende Informationen unter www.bewegbereiter.de.

© Janssen
Drei Klassen von Medikamenten können zur Behandlung der RA eingesetzt werden: nicht-steroidale Antirheumatika, Kortikosteroide und sog. Disease-modifying anti-rheumatic Drugs (DMARD). Obwohl die Folgen der RA über die körperlichen Auswirkungen hinausgehen, zielen viele Therapieansätze bisher vorwiegend darauf ab, die physischen Symptome zu behandeln und die Krankheitsprogression zu verzögern. Um das gesamte Wohlbefinden von Patienten mit RA zu verbessern, können jedoch Therapieansätze erforderlich sein, die umfassender wirken und sowohl die physischen als auch die psychischen Faktoren beeinflussen [11].
IL-6: Rolle in der Pathophysiologie der RA
![Partner in der Immunologie für mehr Lebensqualität Abb. 2: Prozess der strukturellen Knochenschädigung bei der RA (erstellt nach [12–14])](/Bilder/Abb-2-Prozess-der-strukturellen-Knochenschaedigung-bei-der-184750.jpg)
Abb. 2: Prozess der strukturellen Knochenschädigung bei der RA (erstellt nach [12–14])
© Grafik: Springer Medizin Verlag GmbH
Bei der RA infiltrieren Lymphozyten und Monozyten das Synovium und setzen dort proinflammatorische Modulatoren wie TNF, Interferone sowie IL-1, -4, -6, -12, -13, -17 und -21 frei, die die Entzündung und die Destruktion des Gelenks aufrechterhalten [12, 13]. Dazu gehört IL-6, das eine zentrale Funktion bei der Pathophysiologie der RA einnimmt [14] (Abb. 2). Unter den Zytokinen, die in Serum und Synovialflüssigkeit von Patienten mit RA nachgewiesen werden, erreicht IL-6 die höchsten Spiegel. Die IL-6-Spiegel korrelieren zudem stark mit der Krankheitsaktivität und mit dem Grad der Gelenkdestruktion [13].*
Auch weitere Symptome der RA können durch IL-6 beeinflusst werden [13], so z.B. hemmt eine Überproduktion von IL-6 bei Patienten mit RA die Produktion von Erythropoetin und die Erythropoese im Knochenmark und kann dadurch zur Anämie führen. Zudem kann IL-6 die Bluthirnschranke direkt überwinden und beeinflusst die normalen und pathologischen Zustände des Gehirns, wie Studien zeigten [15, 16].
*Weitere Informationen sind abrufbar unter www.entdeckeRAneu.de.
Literatur
1. Sherlock JP et al., Nature Med 2012, 18:1069–1076
2. Moser M, Murphy KM, Nat Immunol 2000, 1:199–205
3. Athie-Morales V et al., J Immunol 2004, 172:61–69
4. Langrish CL et al., J Exp Med 2005, 201:233–240
5. Benson JM et al., Nat Biotechnol 2011, 29:615–624
6. Kavanaugh A et al., Arthritis Care Res 2015, 67:1739–1749
7. Ritchlin C et al., Ann Rheum Dis 2014, 73:990–999
8. Menter et al., J Eur Acad Dermatol Venereol 2016, 30:1148–1158
9. Schett G et al., Arthritis Res Ther 2011, 13:S4
10. Margaretten M et al., Int J Clin Rheumtol 2011, 6:617–623
11. Gettings L, Musculoskeletal Care 2010, 8:99-106
12. Hitchon CA, El-Gabalawy HS, Open Rheumatol J 2011, 5:107–114
13. Gabay C, Arthritis Res Ther 2006, 8:3
14. Dayer J, Choy E, Rheumatology 2010, 49:15–24
15. Zhou AJ et al., Adv Ther 2017, 34:78–90
16. Yarlagadda A et al., Psychiatry (Edgemont) 2009, 6:18–22
STELARA® 45 mg Injektionslösung, STELARA 45 mg/- 90 mg Injektionslösung in einer Fertigspritze, STELARA® 130 mg Konzentrat zur Herstellung einer Infusionslösung.
Wirkstoff: Ustekinumab. Zusammensetz.: 1 Durchstechflasche enth. 45 mg Ustekinumab in 0,5 ml bzw. 130 mg Ustekinumab in 26 ml. 1 Fertigspritze enth. 45 mg Ustekinumab in 0,5 ml bzw. 90 mg Ustekinumab in 1,0 ml. Sonst. Bestandt.: 45 mg Durchstechflasche bzw. 45 mg/90 mg-Fertigspritze: Histidin, Histidinhydrochlorid-monohydrat, Polysorbat 80, Sucrose, Wasser f. Injektionszw.. 130 mg Durchstechflasche: EDTA Binatrium Salz Dihydrat, Histidin, Histidinhydrochlorid-monohydrat, Methionin, Polysorbat 80, Sucrose, Wasser für Injektionszw.. Anw.geb.: STELARA ist für d. Bhdlg. erw. Pat. mit mittelschwerer bis schwerer Plaque-Psoriasis indiziert, bei denen and. systemische Therapien einschl. Ciclosporin, Methotrexat od. PUVA nicht angesprochen haben, kontraindiziert sind od. nicht vertragen wurden. STELARA ist für d. Bhdlg. mittelschwerer bis schwerer Plaque-Psoriasis b. Kindern u. Jugendl. ab 12 Jahren indiziert, d. unzureich. auf and. systemische Therapien od. Phototherapien angesprochen od. sie nicht vertragen haben. STELARA ist allein od. in Kombin. m. Methotrexat für d. Bhdlg. d. aktiven psoriat. Arthritis b. erw. Pat. indiziert, wenn d. Ansprechen auf e. vorherige nicht-biolog. krankheitsmodifiz. antirheumat. (DMARD) Therapie unzureich. gewesen ist. STELARA ist für d. Bhdlg. erw. Pat. mit mittelschwerem bis schwerem aktiven Morbus Crohn indiziert, die entweder auf eine konventionelle Therapie od. einen d. Tumornekrosefaktor-alpha (TNFα) Antagonisten unzureich. angesprochen haben, nicht mehr darauf ansprechen od. eine Unverträglichk. od. eine Kontraindik. gg. eine entsprech. Bhdlg. aufweisen. Gegenanz.: Überempfindl. gg. Ustekinumab od. and. Bestandt.; klin. relevante aktive Infektion (z. B. aktive Tuberkulose); Pat. unter 18 Jahren (Morbus Crohn u. psoriat. Arthritis) bzw. unter 12 Jahren (Plaque-Psoriasis); Schwangerschaft; Stillzeit (b. Entschdg. üb. Aussetzen d. Stillens währ. d. Bhdlg. u. bis zu 15 Wo. danach od. Aussetzen d. Therapie m. STELARA muss Nutzen d. Stillens für d. Kind m. Nutzen d. Therapie für d. Frau abgewogen werden). Vorsicht bei: Pat. mit chron. Infekt. od. einer rezidiv. Infektion in d. Anamnese. Immunsuppressiva wie STELARA können d. Risiko v. malignen Tumoren u. d. Risiko v. Infektionen erhöhen u. latente Infektionen reaktivieren. Pat. mit malignen Tumoren (auch in d. Vorgeschichte). Bhdlg. v. latenter Tuberkulose muss vor Verabreichg. v. STELARA eingeleitet werden. Anti-Tuberkulose-Bhdlg. soll vor Verabr. v. STELARA b. Pat. m. Anamnese v. latenter od. aktiv. Tuberkulose in Betracht gezogen werden, bei denen ein angem. Bhdlgs.verlauf nicht bestätigt werden kann. Pat. sollen angewiesen werden, mediz. Rat einzuholen, wenn Anzeichen od. Sympt. e. Infektion auftreten. Bei anaphylakt. od. and. schweren Überempfindl.reakt. soll d. Verabreichg. v. STELARA sofort abgebrochen u. e. geeign. Therapie eingeleitet werden. B. Auftr. e. exfoliat. Dermatitis (Erythrodermie) od. erythroderm. Psoriasis muss e. angemess. Ther. eingeleitet u. bei V. a. eine Arzneimittelreakt. STELARA abgesetzt werden. Lebendvirus- od. Lebendbakterienimpfstoffe (z. B. Bazillus Calmette-Guérin (BCG)) sollen nicht gleichzeitig m. STELARA verabreicht werden. Vor e. Impfung muss d. Anw. von STELARA mind. 15 Wo. ausgesetzt werden u. kann frühestens 2 Wo. danach wieder aufgenommen werden. Vorsicht, wenn gleichzeitig and. Immunsuppressiva angewendet werden od. wenn e. Wechsel v. and. biolog. Immunosuppressiva erwogen wird. Ältere Pat.. Immuntherapie gg. e. Allergie. Pat. m. Latexüberempfindl.. Nebenwirk.: Erw. Pat.: Häufig: Infekt. d. oberen Atemw., Nasopharyng. Schwindel, Kopfschm., Oropharyngeale Schmerzen, Diarrhö, Nausea, Erbrechen, Pruritus, Rückenschm., Myalgie, Arthralgie, Müdigk., Erythem an d. Injekt.stelle, Schmerzen an d. Injekt.stelle. Gelegentl.: Cellulitis, dentale Infekt., Herpes zoster, Virusinfekt. d. oberen Atemw., vulvovag. Pilzinfektionen, Überempfindl.reakt. (einschl. Hautausschlag, Urtikaria), Depress., Facialisparese, verstopfte Nase, Exfoliat. d. Haut, Akne, pustulöse Psoriasis, Reakt. an d. Injekt.stelle (einschl. Hämorrhagie, Hämatom, Verhärtung, Schwellung u. Pruritus), Asthenie. Selten: schwerwiegende Überempfindl.reakt. (einschl. Anaphylaxie, Angioödem), exfoliat. Dermatitis (Erythrodermie). Pädiatr. Pat.: Die in e. Phase III-Studie berichteten unerwünscht. Ereign. waren denjen. ähnlich, d. in vorangeg. Studien b. Erw. m. Plaque-Psoriasis beob. wurden. Warnhinw.: Alle Pat., bes. diejenigen üb. 60 Jahre sow. Pat. m. einer läng. immunsuppr. Therapie od. PUVA-Bhdlg. in der Anamnese, sollten hinsichtl. d. Auftretens v. nicht-melanozytärem Hautkrebs überwacht werden. Währ. d. Anw. u. für mind. 15 Wo. danach zuverlässige Verhütungsmethoden anwenden. Arzneimittel für Kinder unzugängl. aufbew.. Stand d. Inform.: 10/16. Verschreibungspflichtig. Pharmaz. Unternehmer: Janssen-Cilag International NV, Turnhoutseweg 30, B 2340 Beerse, Belgien. Örtl. Vertreter: Janssen-Cilag GmbH, Johnson & Johnson Platz 1, 41470 Neuss.
Impressum
Unternehmensporträt
„Partner in der Immunologie für mehr Lebensqualität“
Redaktionelle Mitarbeit: Abdol A. Ameri, Weidenstetten
Artikel als Beilage in:
Zeitschrift für Rheumatologie 5/2017 und Orthopädie & Rheuma 3/2017
Mit freundlicher Unterstützung der Janssen-Cilag GmbH, Neuss
Corporate Publishing (verantwortl. i. S. v. § 55 Abs. 2 RStV):
Ulrike Hafner, Tiergartenstraße 17, 69121 Heidelberg
Redaktion: Sabine Jost
Springer Medizin Verlag GmbH, Heidelberger Platz 3, 14197 Berlin
Tel: +49 (0) 61 02 / 506 – 0
Fax: +49 (0) 61 02 / 506 – 203
E-Mail: info@aerztezeitung.de
Die Springer Medizin Verlag GmbH ist Teil der Fachverlagsgruppe Springer Nature
Geschäftsführer: Joachim Krieger, Fabian Kaufmann
Handelsregister Amtsgericht Berlin-Charlottenburg HRB 167094 B
Umsatzsteueridentifikationsnummer: DE 230026696
© Springer Medizin Verlag GmbH
Die Wiedergabe von Gebrauchsnamen, Handelsnamen, Warenbezeichnungen usw. berechtigt auch ohne besondere Kennzeichnung nicht zu der Annahme, dass solche Namen im Sinne der Warenzeichen- und Markenschutz-Gesetzgebung als frei zu betrachten wären und daher von jedermann benutzt werden dürfen. Für Angaben über Dosierungsanweisungen und Applikationsformen kann vom Verlag keine Gewähr übernommen werden. Derartige Angaben müssen vom jeweiligen Anwender im Einzelfall anhand anderer Literaturstellen auf ihre Richtigkeit überprüft werden.