Welche Endpunkte sind patientenrelevant?
Innovation in Studienendpunkten – Studienendpunkte für Innovationen
Klinische Studien müssen weltweit sowohl den Anforderungen der Zulassungsbehörden, als auch den Anforderungen im Rahmen des Marktzugangs und der Erstattung gerecht werden. Betrachtet man die frühe Nutzenbewertung in AMNOG, weichen die Anforderungen an pivotale Studien oft von den Anforderungen der EMA ab. Ein entscheidender Aspekt bei der Planung klinischer Studien stellen die Endpunkte dar. EU-HTA verfolgt einen patientenzentrierten HTA-Ansatz, während Deutschland einen Sonderweg mit der Festlegung von patientenrelevanten Endpunkten beschreitet. Die Operationalisierung von Morbiditätsendpunkten erfordert eine klare Definition der klinischen Relevanz und die Berücksichtigung der Heterogenität der Patientenpopulation. Ein Konsens zwischen medizinischen Fachgesellschaften, klinischer Forschung und Patientenvertretern ist essenziell, um geeignete Endpunkte zu formulieren und relevante Daten zur Lebensqualität zu erfassen. MSD beteiligt sich aktiv an der Weiterentwicklung sowohl klinisch als auch HTA-relevanter Endpunkte. Mit EU-HTA ergibt sich die Chance einer Harmonisierung und Weiterentwicklung von AMNOG hin zur Patientenzentrierung.
Veröffentlicht:
© wladimir1804 / stock.adobe.com
Pharmazeutische Unternehmen als Quelle der Innovation in Deutschland und der Welt
Pharmazeutische Unternehmen spielen seit Jahrzehnten eine zentrale Rolle bei der Entwicklung innovativer Arzneimittel, die die Gesundheitsversorgung weltweit voranbringen. Gemäß einer Studie der European Federation of Pharmaceutical Industries and Associations (EFPIA) investierte die pharmazeutische Industrie im Jahr 2023 fast 50 Milliarden Euro in Forschung und Entwicklung in Europa, wobei etwa die Hälfte (48,4 Prozent) dieser Summen in klinische Studien floss.
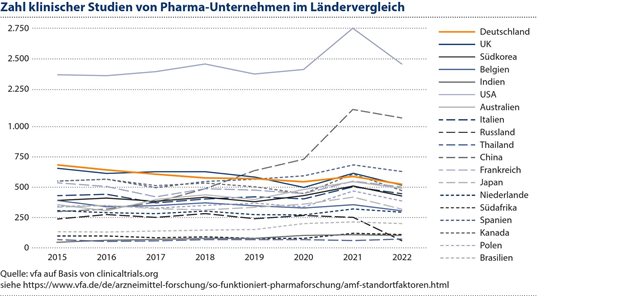
In Deutschland allein investierte die Pharmaindustrie im Jahr 2020 rund 7 Milliarden Euro in Forschung und Entwicklung und rangiert mit 542 klinischen Studien weltweit auf Rang 6 bei der Durchführung von Industrie-initiierten klinischen Studien. Laut einer Analyse von Charles Rivers Associates ist der Privatsektor für knapp zwei Drittel der Investitionen in Forschung und Entwicklung verantwortlich.
Eine große Herausforderung für pharmazeutische Unternehmen (pU): Verschiedene Anforderungen ausbalancieren
Das Design klinischer Studien stellt Sponsoren immer wieder vor erheblichen Herausforderungen. Klinische Studien müssen nicht nur den Anforderungen der medizinischen Wissenschaft, sondern auch den Anforderungen der Zulassungs- und Erstattungsbehörden gerecht werden. Für ein global tätiges Unternehmen wie MSD Sharp & Dohme (MSD), das Medikamente in über 140 Länder vertreibt, bedeutet dies, dass diese Anforderungen berücksichtigt werden müssen, um Zulassung und Marktzugang zu sichern. Hier weichen trotz International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) und europäische HTA-Verordnung/EUnetHTA wichtige Standards immer noch voneinander ab.
© Springer Medizin Verlag
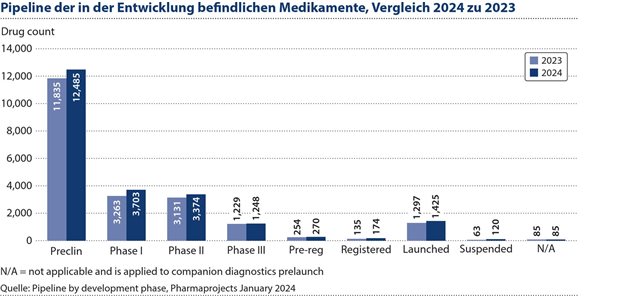
Abbildung 2: Im Durchschnitt schaffen es nur ein bis zwei von je 10.000 aller in der Entwicklung befindlichen Medikamente bis zur Marktreife.
© Springer Medizin Verlag
Bei MSD sind weltweit ungefähr ein Drittel der Mitarbeiter:innen im Bereich Forschung und Entwicklung tätig und arbeiten zur Zeit unter anderem an der Planung und Durchführung von über 2.000 klinischen Studien in 47 Ländern und vier Regionen, darunter 130 klinische Studien in Deutschland, mit Rekrutierung für 20 weitere Studien. Eine Vielzahl interner und externer Experten, darunter auch Kliniker, Operations-Spezialisten, Forschungspartner und Patient:innen, sind an der Erstellung der Studienprotokolle beteiligt. Ziel dabei ist es, durchführbare Studienprotokolle zu erstellen, die den weltweiten Anforderungen entsprechen. Auch deutsche Anforderungen haben einen hohen Stellenwert.
Trotz aller Anstrengungen schaffen es im Durchschnitt nur ein bis zwei von je 10.000 aller in der Entwicklung befindlichen Medikamente bis zur Marktreife.
Operationalisierung von Morbiditätsendpunkten in der Nutzenbewertung
Die Messung der Wirksamkeit, Verträglichkeit, Nützlichkeit und Schädlichkeit von Therapien erfolgt im AMNOG anhand von patientenrelevanten Endpunkten, die durch die Kategorien Mortalität, Morbidität, Nebenwirkungen und gesundheitsbezogene Lebensqualität bewertet werden. Die Frage ist, welche Endpunkte als patientenrelevant erachtet werden und wie sie operationalisiert werden können. Vor allem bei Morbiditätsendpunkten gab es in der Vergangenheit viel Interpretationsspielraum.
1. Klinische Relevanz: Definitionen müssen präzise und aussagekräftig sein, um die beabsichtigten klinischen Effekte angemessen zu messen.
2. Heterogenität des Patientenkollektivs: Es ist wichtig, dass die Endpunkte die Heterogenität der Patient:innen und ihre verschiedenen Krankheitsverläufe angemessen erfassen (Berücksichtigung von Subgruppen).
3. Konsens über Endpunkte: Die Definition von Morbiditätsendpunkten erfordert einen Konsens zwischen verschiedenen Interessengruppen, einschließlich medizinischer Fachgesellschaften, Forschern, Zulassungsbehörden, HTA-Behörden und Patientenvertretern.
4. Datenerfassung und -verfügbarkeit: Die Operationalisierung der Morbiditätsendpunkte muss im medizinischen Alltag umsetzbar sein damit die erforderlichen Daten zur Messung und Bewertung dieser Endpunkte erhoben werden können. Dies gilt vor allem auch für die Erfassung der Lebensqualität.
5. Patientenperspektive: Es ist wichtig, die Perspektive, Bedürfnisse und Präferenzen der Patient:innen bei der Festlegung und Bewertung patientenrelevanter Endpunkte angemessen zu berücksichtigen.
Die Einigung auf geeignete Endpunkte gelingt nicht immer und kann zeitaufwendig und ressourcenintensiv sein.
Im Rahmen des AMNOG kommt erschwerend hinzu, dass die Anforderungen des G-BA bezüglich der Operationalisierung und Messung von patientenrelevanten Endpunkten teilweise die klinische Fragestellung nicht vollständig abbilden. Dies kann dazu führen, dass Medikamente, die für Patient:innen eine wichtige Versorgungslücke schließen, im AMNOG keine Chance auf einen Zusatznutzen haben und somit möglicherweise nicht in Deutschland verfügbar sind.
Beispiel Ereignisfreies Überleben (EFS)
Ein Beispiel hierfür ist der Endpunkt „Ereignisfreies Überleben“ (EFS), der unter anderen den Krankheitsprogress bzw. Rezidive erfasst. In der kurativen Therapiesituation bildet das EFS aus Sicht des IQWiG und G-BA das Scheitern der potenziellen Heilung ab, welches grundsätzlich als patientenrelevant erachtet wird. Als Voraussetzung für die Akzeptanz des Endpunkts fordert der G-BA den Nachweis der Tumorkontrolle bzw. Tumorfreiheit. Insbesondere bei inoperablen Patienten ist die Krankheitsbeurteilung (Tumorkontrolle) im Laufe der Behandlungszeit aufgrund der oft durchgeführten Radiotherapie jedoch erschwert, da es im Zuge der Bestrahlung zu Gewebeveränderungen im Tumorgewebe kommt.
Die Fragestellung der Nutzenbewertung spiegelt somit nicht die der Kliniker wider, was im vorliegenden Beispiel dazu führt, dass sich die Forderungen des G-BA für die pUs nicht umsetzen lassen. Eine engere Abstimmung zwischen G-BA, Fachgesellschaften, Patientenvertretern und der klinischen Forschung ist zwingend erforderlich, um diesem Problem entgegenzuwirken. Ziel muss es sein, klinisch relevante und praktikable Morbiditätsendpunkte zu generieren. Der Bedarf hierfür ist hoch – insbesondere für inoperable Patient:innen mit kurativer Therapieintention.
Das Phänomen der Diskrepanz zwischen den Kriterien des G-BA und der Wirklichkeit im Klinikalltag besteht auch bei operablen Patient:innen. Der G-BA fordert als Voraussetzung für die Akzeptanz von EFS den Nachweis der Tumorfreiheit (R0-Resektion), was dazu führt, dass alle nicht vollständig resezierten Patient:innen in den EFS-Analysen als Ereignis gezählt werden. Nach dem Verständnis des IQWiG und G-BA ist für diese Patient:innen der kurative Therapieansatz gescheitert – und dass, obwohl die Patient:innen durchaus noch eine Chance auf Heilung besäßen.
Bei der Entwicklung des Studienprotokolls stellt sich für den pU die herausfordernde Frage, ob die Operationalisierung des Endpunkts nah am Versorgungsalltag sein soll und somit angemessen die variierenden Krankheitsverläufe der Patient:innen widerspiegelt oder ob der Erfolg der Nutzenbewertung bei der Erfassung des Endpunkts im Mittelpunkt stehen soll. Auch hier steht zur Diskussion, ob die Anforderungen des G-BA an derartige Endpunkte überdacht werden sollten, um den Praxisalltag besser abzubilden und den Patient:innen in den Mittelpunkt zu rücken.
Die Adressierung dieser Herausforderungen erfordert eine sorgfältige Abwägung und Zusammenarbeit zwischen allen beteiligten Parteien, einschließlich der Zulassungsbehörden, der pharmazeutischen Industrie, medizinischer Fachgesellschaften und Patientenvertretungen, um sicherzustellen, dass die Nutzenbewertung im Rahmen des AMNOG angemessen und umfassend erfolgt. Nur so kann sichergestellt werden, dass die Daten der Patient:innen, die Zeit, Engagement und Hoffnung in Studien investiert haben, auch sinnvoll benutzt werden können. Für pUs sowie für Patient:innen sind nicht bewertbare Datensätze eine Verschwendung wertvoller Ressourcen.
Patientenrelevante Endpunkte und Innovationen von morgen
Innovationen von morgen bringen das System vor neue Herausforderungen. Beispielsweise erforscht MSD gemeinsam mit Moderna individualisierte Neoantigentherapien (INT) – auch bekannt als „therapeutische Impfstoffe gegen Krebs“. Das Ziel der INT ist es, das körpereigene Immunsystem bei bereits an Krebs erkrankten Patient:innen so zu aktivieren, dass es bei der Krebsbekämpfung unterstützen kann, um das Risiko eines Rückfalls zu minimieren. Die INT soll dem Immunsystem helfen, individuelle Neoantigene auf den Krebszellen der Patient:innen zu erkennen und zu zerstören.
Die aktuellen Forschungsergebnisse deuten darauf hin, dass die INT-Immunzellen so aktivieren könnten, dass sie die veränderten Neoantigene auf den Krebszellen erkennen und angreifen können. Aufgrund des Gedächtnisses des Immunsystems könnte die INT zu einer langfristigen, spezifischen Erkennung der Krebszellen führen und das Risiko eines Rückfalls verringern. In der Studie V940-001 wird die INT in Bezug auf den primären Endpunkt das Rezidivfreies Überleben (RFS) untersucht. Sekundäre Endpunkte umfassen das fernmetastasefreie Überleben (DMFS), das Gesamtüberleben (OS) und die Sicherheit der Therapie.
Operationalisierung von symptombezogenem progressionsfreiem Überleben (Progression-free survival PFS) (PFS+) mit Hilfe künstlicher Intelligenz
Ein wichtiger Endpunkt in der Onkologie stellt in einigen Indikationsgebieten der Endpunkt PFS dar, der per se in AMNOG nicht als patientenrelevant anerkannt wird. Eine Weiterentwicklung des Endpunktes (PFS+), der PFS mit Krankheitssymptomatik bzw. Lebensqualität verknüpft, könnte ein Weg zur Akzeptanz des Endpunktes in der frühen Nutzenbewertung darstellen, da er den direkten Einfluss des Progresses auf das Befinden des Patienten/der Patientin nachweisen würde. Damit wäre PFS+ im Sinne des AMNOG patientenrelevant. Der Einsatz von künstlicher Intelligenz könnte dabei methodisch unterstützen, um zum Beispiel anhand bestehender Datensätze Muster zu identifizieren, die diesen Zusammenhang nachweisen.
Wird die Zukunft der AMNOG-Endpunkte durch EU-HTA patientenzentriert?
Der medizinische Fortschritt schreitet stetig voran und in bestimmten Fällen sind randomisierte kontrollierte Studien (RCT) daher aus praktischen und ethischen Gründen nicht durchführbar. Diese Dynamik muss auch bei der Bewertung des Zusatznutzens von Arzneimitteln abbildbar sein, um die Abkopplung vom wissenschaftlichen Fortschritt in der Arzneimittelentwicklung zu vermeiden.
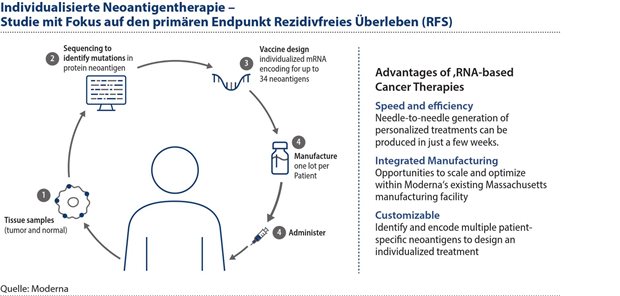
Abbildung 3: Das Ziel der INT ist es, das körpereigene Immunsystem bei bereits an Krebs erkrankten Patient:innen so zu aktivieren, dass es bei der Krebsbekämpfung unterstützen kann, um das Risiko eines Rückfalls zu minimieren.
© Springer Medizin Verlag

Abbildung 4: Mit dem Start der europäischen HTA-Bewertung ab Januar 2025 bietet sich die Chance, methodische Bewertungsgrundsätze besser an den europäischen Rahmen anzugleichen.
© Springer Medizin Verlag
Für besondere Therapiesituationen, wie z. B. Gen- und Zelltherapien, wie auch INTs, für die Studien höchster Evidenzstufe unmöglich oder unangemessen sind, bedarf es daher einer Weiterentwicklung des AMNOG. Mit dem Start der europäischen HTA-Bewertung ab Januar 2025 für onkologische Therapeutika und Arzneimittel für neuartige Therapien (ATMP) bietet sich die Chance für Synergieeffekte. Methodische Bewertungsgrundsätze müssen besser an den europäischen Rahmen angeglichen werden. Es braucht mehr Flexibilität bezüglich der Berücksichtigung von patientenzentrierten Endpunkten und spezifischen Studiendesigns (zum Beispiel indirekte Vergleiche) in Orientierung an europäischen Leitlinien, damit medizinischer Fortschritt auch in Zukunft in Deutschland eine Chance hat.

© privat
Dr. Jutta Wendel-Schrief, ist seit Januar 2015 Leiterin des Geschäftsbereichs Market Access bei MSD Sharp & Dohme GmbH. Jutta Wendel-Schrief studierte Biologie und promovierte zum Dr. phil. nat. im Bereich der Biochemie an der Johann Wolfgang von Goethe-Universität in Frankfurt am Main. Nach mehrjähriger Forschungstätigkeit am Max-Planck-Institut für Biophysik zum Thema Transportproteine arbeitete sie seit 1990 in verschiedenen Firmen im pharmazeutischen Umfeld, in unterschiedlichen Bereichen und Indikationen, hauptsächlich in Marketing und Vertrieb. Von 2010 bis 2015 leitete sie bei der MSD Sharp & Dohme GmbH die Business Unit Klinik- und Spezialprodukte.
Literatur
1 The pharmaceutical industry in figures, EFPIA, edition 2024, siehe the-pharmaceutical-industry-in-figures-2024.pdf Seite 5.
2 vfa auf Basis von clinicaltrials.org siehe https://go.sn.pub/7yka34.
3 Fowler A, Grieve K, Maos A, Wilsdon T. Quantifying public and private investment in European biopharmaceutical research and development. Health Aff Sch. 2024 May 31 siehe Quantifying public and private investment in European biopharmaceutical research and development - PubMed Seite 2.
4 https://go.sn.pub/xdyrkx.
5 Klinische Studien von MSD - msd.de
6 Citeline Clinical, Pharma R&D Annual Review 2024, siehe https://go.sn.pub/1pfji1. Figure 2 Seite 9.