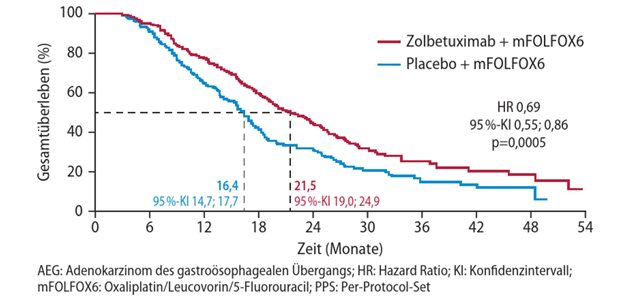
Onkologie
Niraparib bei rezidiviertem Ovarial-Ca zugelassen
MÜNCHEN. Die Europäische Kommission hat Zejula® (Niraparib) zugelassen, teilt das Unternehmen Tesaro mit. Zejula® wird als Monotherapie zur Erhaltungstherapie bei erwachsenen Patientinnen mit Rezidiv eines Platin-sensitiven, gering differenzierten serösen Karzinoms der Ovarien, der Tuben oder mit primärer Peritonealkarzinose, die sich unter Platin-basierter Chemotherapie in Remission (komplett oder partiell) befinden, angewendet. Zejula® sei der erste in Europa zugelassene orale, einmal täglich einzunehmende Poly (ADP-Ribose)-Polymerase (PARP) 1/2-Inhibitor, für den keine Testung des BRCA-Mutationsstatus oder eine andere Biomarkertestung erforderlich sind, so der Hersteller. Die Markteinführung in Deutschland werde im Dezember 2017 erfolgen. (mal)