Gastbeitrag
Eine Medizin, die ins Auge gehen kann
Neue Arzneien können viele Menschen vor Blindheit bewahren. Doch die dazu notwendige ärztliche Leistung - die intravitreale Injektion - ist noch immer nicht in den EBM aufgenommen worden. Die Folge: Viel Ärger in der Praxis.
Veröffentlicht: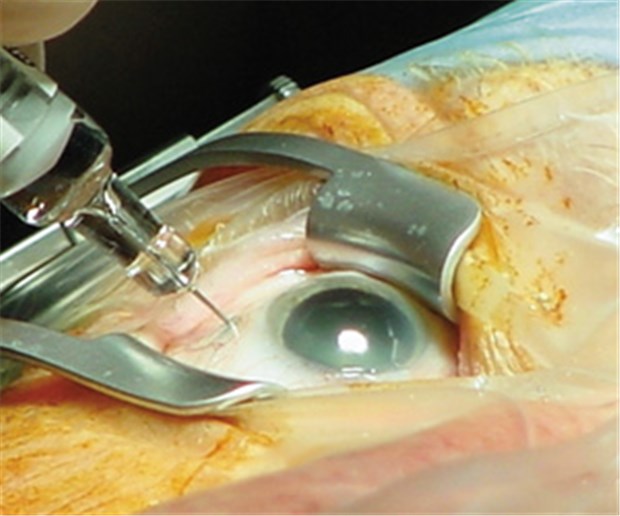
Applikation eines VEGF-Inhibitors ins Auge: abrechenbar nur über die GOÄ.
© H. Grandel / Universitätklinikum Ulm
BERLIN. Begonnen hat alles mit der Entdeckung der VEGF-Inhibitoren mit ihrem neoangiogenese-hemmenden und entzündungsbremsenden Effekt bei der feuchten Maculadegeneration.
Ranibizumab und Bevacizumab, die sich wie Bruder und Schwester ähnlich sind, wurden nach ihrer Entwicklung unterschiedlich vermarktet, obwohl beide das gleiche Wirkungspotential besitzen. Ranibizumab (Lucentis®), im retinalen Bereich, Bevacizumab (Avastin®) in der Onkologie.
Die Hersteller haben nicht die Absicht, eine Vermengung der Indikationsbereiche durch Zulassungsstudien zu belegen. Für Lucentis® wurde nur eine Darreichungsform entwickelt, die intravitreal eingesetzt werden kann und für die Onkologie ungeeignet ist.
Avastin® ist lediglich zum intravenösen Zugang für den onkologischen Markt geprüft. Eine im Auge geprüfte Darreichungsform existiert nicht.
Unternehmenspolitisch will man sich offenbar nicht durch gegenseitigen Wettbewerb weh tun. Über die Hintergründe darf spekuliert werden.
Im Zulassungsverfahren befindet sich für retinale Erkrankungen ein weiterer ähnlicher Konkurrent, der international als VEGF-Trap-Inhibitor bezeichnet wird.
Dr. Jürgen Bausch

© Cui bono
Aktuelle Position: seit 1970 Kinderarzt, seit 1975 in Bad Soden-Salmünster niedergelassen.
Karriere: Jürgen Bausch, Jahrgang 1937, war Vorsitzender der KV Hessen und ist seit 2001 ihr Ehrenvorsitzender. Bausch war viele Jahre als Arzneimittelexperte im Bundesausschuss der Ärzte und Krankenkassen tätig (seit 2004 im Gemeinsamen Bundesausschuss).
Intravitreale Injektion ist Versorgungsstandard
Es ist damit zu rechnen, dass eine Zulassungsentscheidung in den nächsten zwölf Monaten in Europa und USA fallen könnte. Auch dieser Wirkstoff muss intravitreal appliziert werden. Möglicherweise nicht so oft wie Lucentis®.
Die intravitreale Injektion von Wirkstoffen, die noch vor wenigen Jahren eine Ausnahme war, ist inzwischen ambulanter Versorgungsstandard vieler auf die Retinologie spezialisierter Augenärzte geworden.
Es gibt bislang in der kassenärztlichen Versorgung keine EBM-Position, unter der diese Spezialleistung abgerechnet werden kann.
In der GOÄ wurde inzwischen eine analoge Bewertung vorgenommen, mit der diese Leistung privat liquidiert werden kann. Eine Einigung im Bewertungsausschuss über eine angemessene Bewertung dieser ärztlichen Leistung ist - soweit man hört - in weiter Ferne.
Für GKV-Patienten bedeutet dies, dass sie in Vorlage treten müssen, um anschließend von ihrer Kasse Kostenerstattung zu erhalten.
In diesem Kontext gibt es bei einzelnen Kassen Vorabgenehmigungen für eine individuelle Kostenerstattung. Der Wirkstoff wird zu Lasten der GKV abgerechnet.
Kassen tolerieren oder fördern das Vorgehen
Weltweit applizieren Retinologen nicht nur das teure zugelassene Lucentis®, sondern sie verwenden off label Avastin®, indem sie aus der für die Onkologie vorgesehenen Ampulle auseinzeln (oder auseinzeln lassen).
Dadurch verbilligt sich die Behandlung ganz erheblich, was in Deutschland manche Kassen veranlasst hat, diese Vorgehensweise stillschweigend zu tolerieren oder gar vertraglich zu fördern. Mahnende Briefe des Bundesversicherungsamtes haben daran nichts geändert.
Prospektive randomisierte Zulassungsstudien für Avastin® fehlen. Aber kleinere nicht aussagekräftige Studien deuten daraufhin, dass die guten klinischen Erfahrungen vieler Retinologen mit Avastin® nicht auf Phantasien beruhen.
In der CATT-Studie wurden Avastin® und Lucentis® head to head bei der AMD (altersbedingte Maculadegeneration) geprüft. Das Ergebnis bestätigt die Gleichwertigkeit der Wirkstoffe bei der senilen Maculadegeneration.
Was nichts daran ändert, dass es für Avastin® weder eine Zulassung bei Augenerkrankungen gibt, noch eine im Auge geprüfte Darreichungsform.
Nebenwirkung durch Off-label-use
Im Gefolge der CATT-Studie ist eine Kontroverse über eine höhere Nebenwirkungsquote bei Avastin-Patienten entstanden.
Die FDA hat im August 2011 eindringlich davor gewarnt, Avastin® intravitreal zu verwenden, da einige Fälle mir schweren Komplikationen gemeldet worden waren, die nun geprüft werden.
Ähnliche Vorfälle werden auch aus Deutschland berichtet. Genaue Zahlen hat niemand. Der Hersteller von Avastin® rät ausdrücklich davon ab, diesen Wirkstoff außerhalb der Zulassung einzusetzen.
Während bei der senilen feuchten Maculadegeneration (AMD) die gefürchtete Verschlechterung des Sehvermögens vornehmlich der Neovaskularisation zugeordnet werden kann, hat sich bei anderen Erkrankungen der Retina als Ursache für die Sehverschlechterung das Maculaödem als Folge von lokalen Entzündungsprozessen herausgestellt.
Insbesondere das Maculaödem bei der diabetischen Retinopathie, bei der Uveitis und bei den Ast- und Zentralvenenverschlüssen in Folge von intravasalen Thrombosen.
Monatliche Gabe ist auch historisch begründet
Der antinflammatorische Effekt der VEGF-Inhibitoren findet deswegen bei den genannten Retinaerkrankungen seinen Einsatz wie auch die altvertraute Gabe von Corticoiden.
Unabhängig von der Studienlage und dem Zulassungsstatus verwenden Retinologen mehrheitlich die meist monatlich zu spritzenden VEGF-Inhibitoren genauso wie bei der feuchten Maculadegeneration.
Das ist einerseits historisch begründet, als man experimentell begann zu behandeln, weil zugelassene Therapien nicht existierten. Andererseits auch befördert durch eine fehlende EBM-Regelung.
Bei der Uveitis mit Maculaödem ist nun Ozurdex® 700 Mikrogramm Dexamethason zugelassen, welches nur alle sechs Monate appliziert werden muss.
Und bei der Ast- und Zentralvenenthrombose war Ozurdex® das erste zugelassene Therapieprinzip bei Maculaödem.
Diabetisches Maculaödem ist hart umkämpftes Feld
Inzwischen hat Lucentis® ebenfalls die Zulassung, muss aber bis zu sechsmal in einem halben Jahr gegenüber einmal bei Ozurdex® gegeben werden.
Das große Feld des diabetischen Maculaödems wird demnächst von den einschlägigen Substanzen und ihren Anwendern hart umkämpft werden, Lucentis® ist seit Frühjahr 2011 für diese Indikation im Markt.
Neben Dexamethason strebt ein weiterer Hersteller eines bekannten Cortisonderivats (Fluocinolon acetonid) in USA und Europa eine Zulassung für das diabetische Maculaödem an. Der Markt ist in Bewegung.
Es handelt sich vornehmlich um alte Menschen, von deren Krankheiten hier die Rede ist. Diese fürchten vor allem den Verlust ihrer Alltagskompetenz durch Verlust oder Verschlechterung ihres Sehvermögens.
Sie sind ohnehin meist durch weitere Leiden - Arthrose, kardiovaskuläre probleme, Neuropathien - bereits eingeschränkt zu Wege.
GBA könnte Anstoß geben durch Therapiehinweise
Der hohe Leidensdruck bei Sehstörungen veranlasst die Inanspruchnahme des Systems. Dies ist bei den retinalen Erkrankungen unübersichtlich und nicht patientenfreundlich geregelt.
Falsche Leistungsanreize provozieren Vorgehensweisen, die eine seriöse Nutzenrisikoabschätzung durch Missachtung des Zulassungsstatus und der intravitrealen Applikationsfrequenzen vermissen lassen.
Die Erkenntnis ist banal: immer wenn man als Arzt in den Körper eines Menschen ein Medikament durch Injektion inkorporiert, entsteht eine Infektionsgefährdung.
Das ist mitunter unvermeidlich, wenn auch selten. Aber wo man ein Risiko vermeiden kann, ohne das Therapieziel zu gefährden, sollte man es tun.
Der Gemeinsame Bundesausschuss könnte durch klare Therapiehinweise den Anstoß geben, die Versorgung dieser Menschen mit retinalen Erkrankungen wirtschaftlicher und risikoärmer zu gestalten, nachdem zugelassene Therapien nunmehr zur Verfügung stehen.
Vielleicht spornt das dann den Bewertungsausschuss an, eine systemadäquate EBM-Regel zu finden als Voraussetzung für ein geordnetes Versorgungsmanagement im Sachleistungssystem der GKV.
Intravitreale Injektion: Lücke im EBM
Kassenärztliche Bundesvereinigung und Krankenkassen spielen im Gemeinsamen Bewertungsausschuss ein Vabanque-Spiel - auf Kosten vor allem älterer Patienten.
Immer wieder stand dort - nicht zuletzt auf Drängen des Bundesgesundheitsministeriums - eine Entscheidung über die Einführung einer Leistungsziffer "intervitreale Injektion" an. Ohne Ergebnis.
An den zusätzlichen Kosten - höchstens ein kleiner zweistelliger Millionenbetrag - kann es bei einem Honorarzuwachs von 4,5 Milliarden Euro nicht liegen. Eher wahrscheinliche Gründe sind: Mit einer Pauschalvergütung für ärztliche Leistung und Arzneimittel beim Off-Label-Use verdienen Augenärzte mehr Geld. Und die Kassen können daran sparen.
Dass der Off-Label-Use nicht ohne Risiko ist und Ärzte und die volle Haftung tragen, bleibt unbeachtet. (HL)