Erprobung von Medizinprodukten noch unklar
Nicht nur Arzneimittel, sondern auch Medizintechnikprodukte sollen einer Nutzenbewertung unterzogen werden - in einigen Fällen wird aus dem "Kann" ein "Muss". Wie diese Erprobung aber genau aussieht, soll der Gemeinsame Bundesausschuss festlegen.
Veröffentlicht: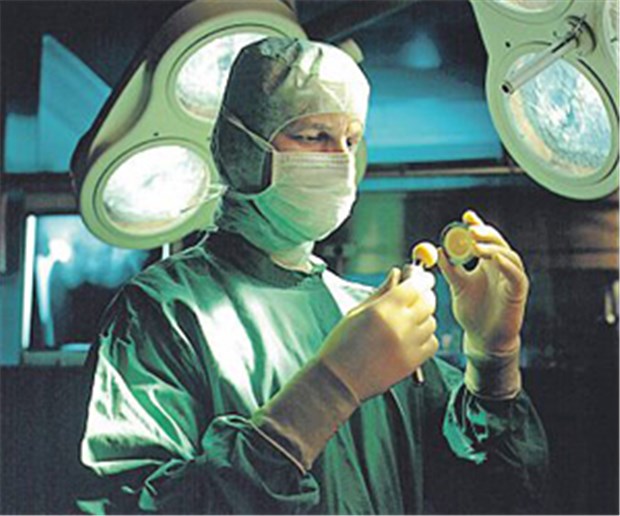
Ein Arzt prüft einen keramischen Kugelkopf und –pfanne für ein künstliches Hüftgelenk. Für solche Produkte soll es eine Nutzenbewertung geben.
© BVMed
Von Ilse Schlingensiepen
KÖLN. In der Medizintechnik wird die Nutzenbewertung zwar an Bedeutung gewinnen, sie wird aber nicht die gleiche Rolle spielen wie bei neuen Arzneimitteln.
"Wir haben eine recht überschaubare Zahl von Innovationen im medizintechnischen Bereich, die für die Nutzenbewertung durch den Gemeinsamen Bundesausschuss von Interesse sind."
Das sagte Dr. Matthias Perleth, Leiter der Fachberatung Medizin beim Gemeinsamen Bundesausschuss (GBA), bei einer Informationsveranstaltung von MedInform, dem Informations- und Seminarservice des Bundesverbandes Medizintechnologie.
Bewertung nur für jedes zehnte Produkt relevant
Ist ein Produkt Teil einer diagnostischen oder therapeutischen Methode, deren Nutzen bereits nachgewiesen ist, sei die Nutzenbewertung nicht erforderlich, sagte Perleth und nannte als Beispiel ein neues Hämodialysegerät.
Dasselbe gelte für Medizinprodukte einer niedrigen Risikoklasse. Nach Angaben des BVMed gehören nur knapp zehn Prozent der Produkte in die beiden höchsten Risikoklassen, bei denen die Nutzenbewertung voraussichtlich greifen wird.
Der GBA kann bei einer neuen Untersuchungs- oder Behandlungsmethode (NUB) mit unklarer Evidenz die Beratungen aussetzen und das Ergebnis weiterer Studien abwarten. "Das geschieht oft mit Qualitätssicherungsauflagen", sagte Perleth.
Das Versorgungsstrukturgesetz hat den Handlungsspielraum des Gremiums erweitert. Nach Paragraf 137e Sozialgesetzbuch V kann der GBA eine Erprobung beschließen, die "das Potenzial einer erforderlichen Behandlungsalternative" aufweisen, ohne dass der Nutzen bereits belegt ist. Während der Erprobungsphase müssen die Kassen die Leistung bezahlen.
Die gesetzlichen Vorgaben zur Erprobungsregelung zielen auf Methoden, nicht auf einzelne Medizinprodukte. Notwendig ist nach Angaben von Perleth eine genauere Definition des Methodenbegriffs.
Verpflichtend ist die Erprobung nach Paragraf 137e nicht. Das wird sie aber bei den Methoden, bei denen der GBA bislang die Bewertung ausgesetzt hat, wenn keine Studienergebnisse absehbar sind.
"Wenn Hersteller sich weitern, muss der GBA die Methode ausschließen"
Der Ausschuss muss jetzt seine Verfahrensordnung an die Erprobungsregelung anpassen. "Wir arbeiten mit Hochdruck an einer Lösung", berichtete der Mediziner.
Ungeklärt ist unter anderem die Frage, wie die vom Gesetzgeber vorgesehene angemessene finanzielle Beteiligung der Hersteller an der wissenschaftlichen Begleitung der Erprobung aussehen soll.
Bei der Beratung der Unternehmen wird sich der GBA wahrscheinlich am Arzneimittel-Bereich orientieren und Gebühren verlangen. Ein entsprechendes Angebot sollte möglichst bald zur Verfügung stehen, sagte Perleth. "Der Beratungsbedarf ist sehr hoch."
Will sich ein Unternehmen nicht an einer Erprobungsregelung beteiligen, hat das klare Konsequenzen: "Wenn Hersteller sich weigern, muss der GBA die Methode ausschließen."
Die Industrie stelle sich nicht gegen die Erprobungsregelung, betonte BVMed-Geschäftsführer Joachim Schmitt. "Die Frage ist aber, mit was vergleicht man und wie."
Anders als bei Arzneimitteln gebe es in der Medizintechnologie keinen homogenen Markt, sagte der Rechtsanwalt Dr. Christian Rybak von der Münchener Kanzlei Ehlers, Ehlers & Partner.
Positive Innovationen schnell erkennen
Die große Bandbreite unterschiedlicher Produkte - von Hilfsmitteln bis zu Implantaten und Diagnostika - muss sich seiner Einschätzung nach in der Nutzenbewertung niederschlagen.
"Die Vielfalt der Medizinprodukte erfordert letztendlich auch eine Differenzierung im Hinblick auf die anzuwendenden Methoden der Bewertung", sagte Rybak.
Um aus der Flut von Innovationen die sinnvollen herausfiltern zu können, seien aussagefähige Daten über den Nutzen, die Wirtschaftlichkeit und die medizinische Notwendigkeit erforderlich, sagte Jürgen Malzahn, Abteilungsleiter Stationäre Versorgung und Rehabilitation beim AOK-Bundesverband.
"Wir brauchen ein System, das uns möglichst schnell in die Lage versetzt, positive Innovationen schnell zu erkennen und andere aus dem System wieder herauszubekommen, die keinen Nutzen haben oder sogar schaden", forderte er.
Die Evaluierung der NUB darf nach Meinung von Malzahn bei der Markteinführung der Produkte nicht stehen bleiben. "Wir brauchen valide Informationen darüber, wie die Risiken und der Nutzen sind."