Kandidat für Galenus-Preis 2019
Vyxeos®– Daunorubicin und Cytarabin in fixer, optimierter Kombination bei AML
Vyxeos® (CPX-351) von Jazz Pharmaceuticals ist eine liposomale Formulierung mit der fixen Kombination von Daunorubicin und Cytarabin im molaren Verhältnis von 5:1. Mit CPX-351 kann bei Hochrisiko-AML-Patienten im Alter von 60–75 Jahren das Gesamtüberleben gegenüber dem 7+3-Schema deutlich verbessert werden.
Veröffentlicht: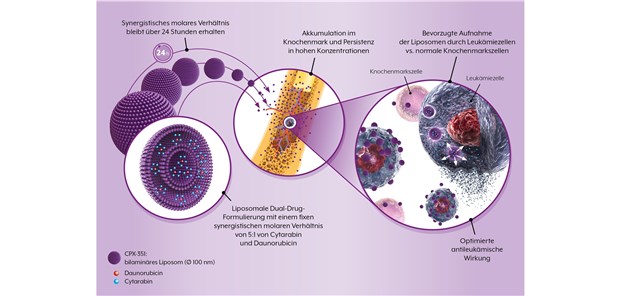
Die akute myeloische Leukämie (AML) ist eine vorwiegend im höheren Erwachsenenalter auftretende Erkrankung. Besonders bei älteren Patienten kann die Therapie aufgrund schwerwiegender Begleiterkrankungen und der komplexen Genetik der Leukämie eine Herausforderung sein. Die Prognose ist für Patienten mit therapiebedingter AML (t-AML) oder sekundärer AML (sAML) besonders ungünstig und der Behandlungsfortschritt aufgrund der geringen Zahl an klinischen Studien eingeschränkt. Obwohl diverse neue Substanzen zur Behandlung der AML untersucht wurden, konnte vor allem für Patienten über 60 Jahre und Hochrisikopatienten kein klinisch relevanter Fortschritt erzielt werden.
Bei AML-Patienten ist die Kombination von Daunorubicin und Cytarabin im sogenannten 7+3-Schema eine Standard-Induktionstherapie. Obwohl In-vitro-Untersuchungen deutliche Unterschiede der zytotoxischen Aktivität bei verschiedenen Mengenverhältnissen ergaben, erschwerte die unterschiedliche Pharmakokinetik der beiden Wirkstoffe die Verabreichung in konstanten molaren Verhältnissen.
Effektive molare Bioverfügbarkeit
Mit CPX-351 (Vyxeos®) von Jazz Pharmaceuticals liegt eine liposomale Formulierung in einer fixen synergistisch wirkenden Kombination von Daunorubicin und Cytarabin vor. Es handelt sich um die erste liposomale Dual-Drug-Formulierung, die durch eine optimierte Verabreichung und die synergistische Bioverfügbarkeit der beiden Wirkstoffe zu einer deutlich verbesserten Wirksamkeit der Einzelsubstanzen führt. Einen relevanten Fortschritt stellt das Präparat somit einerseits bezüglich der optimierten Therapie von älteren Hochrisiko-AML-Patienten und andererseits durch die neuartige liposomale Formulierung der Wirkstoffe in einem fixen synergistischen Verhältnis durch die CombiPlex®-Technologie dar.Die Europäische Arzneimittel-Agentur hat das Präparat zur Behandlung von Erwachsenen mit neu diagnostizierter, therapiebedingter akuter myeloischer Leukämie (t-AML) oder AML mit myelodysplastischen Veränderungen (AML-MRC) zugelassen. Seit September 2018 ist es als Pulver für ein Konzentrat zur Herstellung einer Infusionslösung erhältlich.
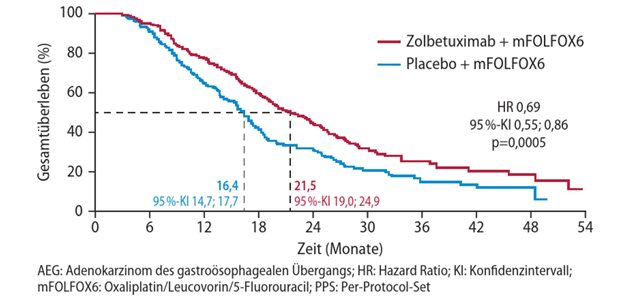
Die Zulassung beruht auf den Daten einer randomisierten, offenen, multizentrischen Phase-III-Studie, in der ein Gesamtüberlebensvorteil im Vergleich zu dem 7+3-Schema nachgewiesen wurde.
In die Zulassungsstudie eingeschlossen waren 309 nicht vorbehandelte Patienten mit t-AML, AML mit vorausgehendem myelodysplastischem Syndrom (MDS), AML mit vorausgehender CMML (chronische myelomonozytäre Leukämie) sowie Patienten mit de novo AML mit MDS-Karyotyp. Die Patienten waren im Median 68 Jahre alt und wiesen mehrheitlich eine intermediäre oder ungünstige Zytogenetik auf.
Gesamtüberlebensvorteil für Ältere
Die Studienteilnehmer erhielten randomisiert eine Induktionstherapie mit ein bis zwei Zyklen CPX-351 gefolgt von ein bis zwei Zyklen CPX-351-Konsolidierung oder eine Induktion mit ein bis zwei Zyklen Cytarabin plus Daunorubicin in freier Kombination (7+3-Schema) gefolgt von ein bis zwei Zyklen 5+2-Konsolidierung. Primärer Studienendpunkt war das Gesamtüberleben.Unter CPX-351 wurde das Gesamtüberleben gegenüber dem Kontrollregime von 5,95 auf 9,56 Monate signifikant verlängert (p = 0,005). Das Sterberisiko wurde um 31 Prozent reduziert. Die Gesamtüberlebensrate nach einem Jahr betrug 42 Prozent (CPX-351) versus 28 Prozent (7+3-Schema). Nach zwei Jahren lebten 31 Prozent versus 12 Prozent der Patienten in den beiden Studienarmen. Ein komplettes Ansprechen erreichten 37 Prozent der Patienten unter CPX-351 sowie 26 Prozent der Patienten unter dem 7+3-Schema (p = 0,04).
Das allgemeine Sicherheitsprofil war in beiden Studienarmen vergleichbar. Die am häufigsten aufgetretenen unerwünschten Ereignisse von Grad 3–5 waren febrile Neutropenie (68 versus 70,9 Prozent), Pneumonien (19,6 versus 14,6 Prozent) und Hypoxie (13,1 versus 15,2 Prozent).
Frühe Mortalität (unter 30 Tage) wurde bei 5,9 Prozent (CPX-351) versus 10,6 Prozent (7+3-Schema) der Patienten gesehen. Innerhalb von 60 Tagen starben 13,7 versus 21,2 Prozent der Patienten unter CPX-351. Die 60-Tage-Mortalität aufgrund von Nebenwirkungen betrug 10,4 Prozent versus 9,9 Prozent. Infolge einer Krankheitsprogression starben in diesem Zeitraum 3,3 Prozent der Patienten im CPX-351-Studienarm versus 11,3 Prozent der Patienten im Kontrollarm. Die Behandlungsdauer war mit median 62 versus 41 Tagen länger für Patienten im CPX-351-Studienarm.
Der Gemeinsame Bundesausschuss (G-BA) hat im März 2019 CPX-351 als Orphan Drug aufgrund des Überlebensvorteils einen beträchtlichen Zusatznutzen zuerkannt. (ine)