EU
Neue Medizinprodukteverordnung sorgt für Unruhe
Durch die novellierte EU-Medizinprodukteverordnung könnte es zum Engpass bei Neuzulassungen kommen – auch wegen des Fachkräftemangels –, warnt die Branche. Das ruft die Wirtschaftsministerkonferenz auf den Plan, die die Regierung in der Pflicht sieht.
Veröffentlicht: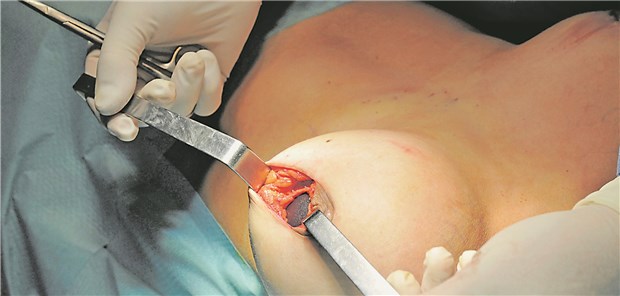
Minderwertige Implantate lösten die Novelle der EU-Medizinprodukteverordnung mit aus.
© Bruno Bebert / dpa
NEU-ISENBURG. Die Prognose war nicht übertrieben, die Vertreter kleinerer und mittelständischer Unternehmen (KMU), aber auch Platzhirsche der deutschen Medizintechnikbranche in den vergangenen Jahren auf Wirtschafts- und Politikforen im Zuge des Novellierungsverfahrens der europäischen Medizinprodukte-Verordnung (Medical Device Regulation / MDR) abgegeben haben.
Für viele KMU könnte die zum 25. Mai 2017 in Kraft getretene MDR den Todesstoß bedeuten. Konkret geht es um das Scrutiny-Verfahren und damit um regulatorische Neuregelungen, die auch die Benannten Stellen wie TÜV oder Dekra betreffen.
Hier konnte sich Deutschland mit seiner Kritik gegen die anderen EU-Staaten im MDR-Gesetzgebungsverfahren nicht durchsetzen. So sieht die novellierte MDR die zusätzliche Überprüfung der Konformitätsbewertung der Benannten Stellen durch ein weiteres Prüfgremium vor.
Warnung vor Schmalspur-Consultants
In der Konsequenz heißt dies, die Benannten Stelle benötigen ihrerseits hunderte, wenn nicht sogar tausende Fachkräfte, um gerade den KMU die umfassenden regulatorischen Dienstleistungen für ihre Medizinprodukte mit Blick auf die MDR-Anforderungen anbieten zu können.
Fakt ist aber auch – so wurde dies von großen wie kleinen Marktteilnehmern zum Beispiel bereits bei einer MDR-Tagung des Bundesverbandes Medizintechnologie (BVMed) im Mai 2016 in Bonn unisono beklagt –, dass eben diese Fachkräfte – unter anderem Ingenieure mit MDR-spezifischer, fachlicher Zusatzqualifikation – am Markt nur sehr begrenzt verfügbar sind, diese sogar beste Konditionen bei ihren zukünftigen Arbeitgebern herausverhandeln könnten.
Gewarnt wurde in Bonn auch von Schmalspur-Consultants, die die knapp 600 Seiten starke MDR nur in Grundzügen verstanden hätten, aber in den Beratungsmarkt einstiegen – und damit speziell für KMU, die mit der MDR mehrheitlich organisatorisch überfordert seien, keine qualitativ hochwertigen Dienste erbringen könnten.
"Aktuell gibt es in der EU nur noch 59 Benannte Stellen für Medizinprodukte – von ursprünglich 90. Damit sind bereits heute bei den Benannten Stellen Kapazitätsprobleme vorhanden.
Hersteller müssen daher lange Wartezeiten in Kauf nehmen, bevor sie die notwendigen Zertifizierungen erlangen, um ihre Produkte in Verkehr bringen zu können", warnten die Branchenverbände BAH, BPI, BVMed, SPECTARIS, VDDI und ZVEI anlässlich des ersten Jahrestages des Inkrafttretens der neuen MDR.
Mit dieser will die EU nach dem 2010 ins Rollen gekommenen, gerichtlich noch immer nicht abschließend aufgearbeiteten Skandal um mit Industriesilikon befüllte, minderwertige Brustimplantate des inzwischen insolventen französischen Anbieters Poly Implant Prothèse (PIP) mit Blick gerade auf Medizinprodukte höherer Risikoklassen für mehr Patientensicherheit und Gesundheitsschutz sorgen.
Die Unmutsbekundungen der Branche haben indes sogar schon die Landeswirtschaftsminister auf den Plan gerufen. Bei ihrer jüngsten Wirtschaftsministerkonferenz (WMK) am saarländischen Bostalsee flossen die Bedenken der Medizintechnikunternehmen in die Beschlüsse ein.
Fristverlängerungen sollen Spielraum schaffen
Insbesondere wegen der KMU sollte sich die Bundesregierung aktiv in den Prozess der Weiterentwicklung des Rechtsrahmens durch die EU-Kommission einbringen, so eine konkrete Forderung.
Dazu gehörten eine Verlängerung der geltenden Übergangsfristen für die MDR (bisher Mai 2020) und auch die novellierte In Vitro Diagnostic Regulations (IVDR, bisher Mai 2022) sowie eine deutliche Reduzierung der Anforderungen bei der Neuzertifizierung bewährter Bestandsprodukte.
Auf nationaler Ebene sollten keine zusätzlichen Verschärfungen bei der Implementierung der MDR vorgenommen werden und kritisch geprüft werden, inwiefern die Rechtsakte von KMU auch umgesetzt werden können.
"Angesichts hoher Dynamik und kurzer Innovationszyklen in der Medizintechnik stellt die in den Verordnungen vermehrt geforderte klinische Evidenz insbesondere KMU vor erhebliche finanzielle Herausforderungen.
Die Wirtschaftsministerkonferenz betont deshalb die Notwendigkeit, geeignete Unterstützungsmöglichkeiten für den besseren Zugang zur klinischen Erprobung neuer innovativer Medizinprodukte vor allem für KMU der Medizintechnik zu schaffen und bittet die Bundesregierung, dies in der Fortführung des Strategieprozesses Medizintechnik zu berücksichtigen", heißt es in den Beschlüssen.
Besonders den Bundesländern mit stark KMU-geprägten Medizintechnkibranchen wie Baden-Württemberg oder Bayern drückt der MDR-Schuh gewaltig.





