Galenus-Grundlagenpreis
Neuer Ansatz gegen Parkinson, CJK und Alzheimer
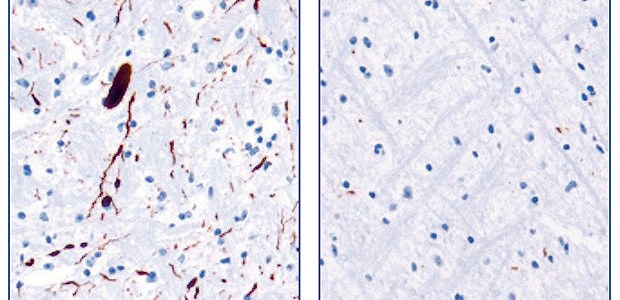
Die therapeutische Wirksamkeit von Anle138b konnte unter anderem in transgenen Parkinson-Mäusen nachgewiesen werden: In ihrem Hirngewebe finden sich pathologische -Synuclein-Ablagerungen (braun gefärbte Flecken im li. Bild). In Mäusen, die Anle138b mit dem Futter verabreicht bekamen, bilden sich deutlich weniger Ablagerungen (re. Bild).
© Griesinger/Giese
Bei vielen neurodegenerativen Krankheiten verklumpen Proteine im Gehirn. Oft bilden sie sich aus kleineren Vorstufen, den Oligomeren. Den Teams der Professoren Christian Griesinger und Armin Giese ist es nun gelungen, eine Substanz zu entwickeln, die sich gezielt gegen Oligomere richtet.
Das Interview führte Thomas Müller
Ärzte Zeitung: Sie glauben, Ihre Entdeckung könnte ein Durchbruch bei der Therapie von Krankheiten wie Parkinson, Creutzfeldt-Jakob oder gar Alzheimer sein. Was macht Sie da so zuversichtlich?
Professor Christian Griesinger: Die Substanz Anle138b hemmt die Aggregation von Prionprotein, Alpha-Synuclein, Beta-Amyloid und Tau-Protein.
In Tiermodellen sterben damit weniger Neurone ab, das Verhalten wie Beweglichkeit oder Erinnerungsvermögen wird verbessert, und die Lebenszeit der Tiere verlängert sich teilweise dramatisch.
Wie kann man sich die Wirkweise vorstellen?
Griesinger: Protein-Aggregate wie Alpha-Synuclein oder Beta-Amyloid gibt es etwa als lange Fibrillen und als kleinere Vorstufen, sogenannte Oligomere. Diese Oligomere gelten zunehmend als die eigentlichen Übeltäter bei Krankheiten wie Parkinson oder Alzheimer.
Bei einer Behandlung mit unserer Substanz verschwinden die Oligomere weitgehend - sowohl in vitro als auch im Tiermodell.
Aggregationshemmer kennt man schon seit einiger Zeit. Was ist das Besondere an Anle138b?
Griesinger: Substanzen wie EGCG aus grünem Tee oder Curcumin aus Gelbwurzel beeinflussen zwar ebenfalls die Aggregation von Alpha-Synuclein oder Beta-Amyloid.
Sie erreichen aber keine wirksamen Konzentrationen im Gehirn. Anle138b ist oral verfügbar, erzeugt dabei relativ hohe Konzentrationen im Gehirn und hemmt zugleich sehr wirksam die Aggregation. Das hat bisher keine Substanz geschafft.
Wie haben Sie Anle138b entdeckt?
Griesinger: Beim Screening von über 20.000 Substanzen unter Leitung von Professor Armin Giese zeigten Diphenyl- Pyrazole die besten Eigenschaften. In unserer Gruppe haben wir diese Substanzen chemisch modifiziert und optimiert.
Dabei erwies sich Anle138b als geeignete Substanz, was Bioverfügbarkeit und Aktivität betrifft. Wir haben zwar noch wirksamere Aggregationshemmer gefunden, die gehen aber nicht so gut ins Gehirn.
Mit welchen Experimenten konnten Sie die Wirksamkeit zeigen?
Griesinger: An einem Mausmodell für die Creutzfeldt-Jakob-Krankheit (CJK) haben wir die Substanz gegen Prionprotein-Aggregate getestet. Die Arbeitsgruppe um Armin Giese hat Mäuse mit Scrapie-Protein inokuliert. Solche Tiere sterben in der Regel nach 170 bis 180 Tagen.
Beginnt man gleichzeitig mit der Inokulation auch mit der Anle138b-Behandlung, leben die Mäuse im Schnitt 360 Tage - das ist die größte Lebenszeitverlängerung, die man in solch einem Modell beobachtet hat.
Startet die Therapie erst nach 120 Tagen, wenn die Mäuse schon klinisch auffällig sind, dann ist der Effekt zwar geringer, aber die Lebenszeit lässt sich immer noch um 70 Tage verlängern.
Die Wirkung gegen Alpha-Synuclein-Aggregate haben wir in drei unterschiedlichen Mausmodellen für Parkinson getestet. In allen drei Modellen sahen wir einen "Rescue-Effekt": Bei Bewegungstests fielen Defizite schwächer aus oder verzögerten sich deutlich, es starben weniger Neurone ab und die Bildung von Alpha-Synuclein-Ablagerungen verringerte sich um etwa einen Faktor 4.
Hat Anle138b nicht auch Auswirkungen auf physiologisch wichtige Aggregate?
Griesinger: In einem Tiermodell haben wir die Substanz 16 Monate täglich verabreicht, ohne negative Effekte zu sehen. Da Anle138b auch Porenbildung in der Membran durch Oligomer-Aggregate verhindert, was Neurone durchlöchert und sie schädigt, haben wir geschaut, wie es bei Ionenkanälen aussieht.
Hier haben wir keine negativen Effekte beobachtet. Auch die Bildung von physiologischen Fibrillen wie zum Beispiel Aktin-Filamenten wird nicht gestört.
Wann rechnen Sie mit klinischen Studien?
Griesinger: Die toxikologischen Tests dürften noch etwa ein Jahr dauern. Verlaufen sie erfolgreich, könnten wir Anfang 2015 mit einer Phase-I-Studie beginnen. Wir planen zunächst Studien mit CJK-Patienten, denn nach unseren Experimenten könnten sie auch noch im klinischen Stadium profitieren.
Als nächstes wären Parkinson-Patienten im präklinischen Stadium geeignet, etwa solche mit einer Genmutation für Parkinson. Bei ihnen weiß man sicher, dass sie die Krankheit bekommen - wir könnten sie dann vor den ersten Symptomen behandeln.
Das Forschungsthema
Gegen neurodegenerative Erkrankungen wie CJK, Parkinson oder Alzheimer gibt es bislang allenfalls symptomatische Therapien. Zwei Arbeitsgruppen um Prof. Christian Griesinger aus Göttingen und Prof. Armin Giese aus München haben nun eine Substanz entwickelt, die kausal gegen solche Krankheiten wirksam sein könnte.
Mithilfe der fluoreszenzbasierten Einzelmolekülspektroskopie konnten sie zunächst Diphenyl-Pyrazol (DPP) als Leitsubstanz für eine Hemmung der Aggregation von Prionproteinen aufspüren. Von dieser Substanz erzeugten sie etwa 150 Derivate, die sie in vitro und im Tierversuch prüften.
Das DPP-Derivat Anle138b zeigte neben einer guten Aggregationshemmung von Prionprotein und Alpha-Synuclein auch günstige pharmakokinetische Eigenschaften, etwa eine gute Hirngängigkeit. Im Tiermodell für CJK und Parkinson ließen sich damit Ausbruch und Verlauf der Erkrankungen deutlich verzögern (Acta Neuropathol 2013, 125: 795-813). Die Substanz moduliert aber auch die Aggregation der Alzheimerproteine Beta-Amyloid und Tau sowie von Proteinen bei frontotemporaler Demenz oder ALS.
Die Forschungsleiter
Prof. Christian Griesinger ist seit 1999 Direktor der Abteilung NMR-basierte Strukturbiologie am Max-Planck-Institut für biophysikalische Chemie in Göttingen. Er studierte von 1979 bis 1986 Chemie und Physik an der Universität Frankfurt.
Forschungsschwerpunkte sind die Entwicklung der NMR spektroskopischen Methodik sowie die Synthese und Strukturanalyse biologisch aktiver Moleküle mithilfe der NMR-Spektroskopie.
Prof. Armin Giese leitet eine Arbeitsgruppe am Zentrum für Neuropathologie und Prionforschung der LMU München. Giese studierte von 1987 bis 1994 Medizin in Kiel und London.
Forschungsschwerpunkte sind die molekulare Pathologie neurodegenerativer Krankheiten, die Rolle pathologischer Proteinaggregate sowie die Entwicklung von Therapeutika mithilfe der fluoreszenzbasierten Einzelmolekülspektroskopie.
Die Forscherteams
Abteilung NMR-basierte Strukturbiologie am MPI für biophysikalische Chemie, Göttingen
Professor Christian Griesinger (Forschungsleiter)
Dr. Andrei Leonov
Sergey Ryazanov
Zentrum für Neuropathologie und Prionforschung der LMU München
Professor Armin Giese (Forschungsleiter)
Dr. Johannes Levin; Song Shi
Dr. Jens Wagner (derzeit: Deutsches Zentrum für Neurodegenerative Erkrankungen, Bonn)