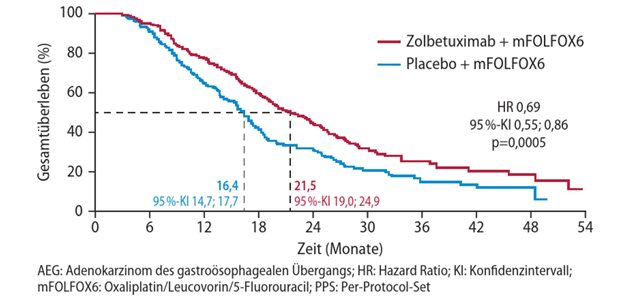
Onyx sieht zweiter Zulassung entgegen
SOUTH SAN FRANCISCO (cw). Das US-Unternehmen Onyx Pharmaceuticals, Entwickler von Bayers verkaufsstarkem Nierenkrebsmittel Nexavar® (Sorafenib), sieht seiner zweiten Produktzulassung entgegen.
Veröffentlicht:Ein Expertenkomitee der US-Behörde FDA hat einstimmig die Marktfreigabe für Kyprolis™ (Carfilzomib) befürwortet. Der Proteasom-Inhibitor "der nächsten Generation" ist für die Behandlung von Patienten mit rezidivierendem refraktären multiplem Myelom vorgesehen.
Die FDA ist an das Votum des Expertengremiums nicht gebunden, weicht aber normalerweise nicht davon ab. Die Behörde will ihre endgültige Entscheidung zur Zulassung von Kyprolis™ am 27. Juli treffen.
Die Börse reagierte auf die positive Nachricht mit einem Kurssprung der Onyx-Aktie von fast 40 Prozent. Bei der EMA hat Onyx die Zulassung für das Krebsmittel ebenfalls beantragt.