Boehringer-Ingelheim
Zulassung für Adalimumab-Similar eingereicht
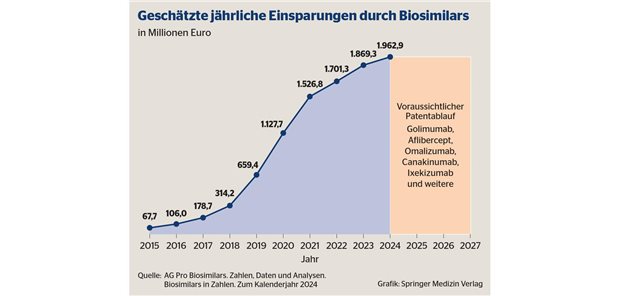
Ingelheim. Boehringer Ingelheim hat weiterhin gute Chancen, zu den ersten zu gehören, die ein Biosimilar des verkaufsstarken Rheuma-Antikörpers Adalimumab (Original: Humira® von Abbvie) in den Markt bringen können. Wie das Familienunternehmen am Mittwoch mitteilte, haben sowohl die US- Zulassungsbehörde FDA als auch die europäische Arzneimittelagentur EMA jetzt Zulassungsanträge für den Nachbau ("BI 695501") angenommen. Für Boehringer sei es der erste Biosimilarkandidat, den man ins Zulassungsverfahren bringe, heißt es.
Derzeit arbeitet das Unternehmen nach eigenen Angaben nur noch an einem weiteren Biosimilar, einer Kopie des Roche-Blockbusters Avastin® (Bevacizumab). (cw)