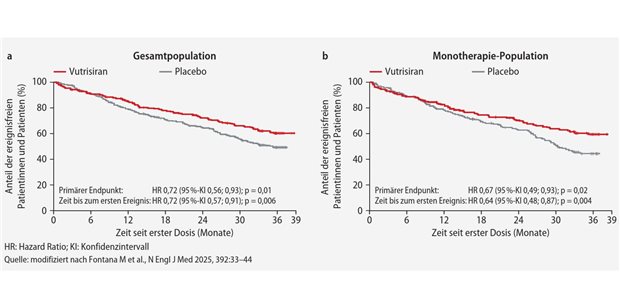
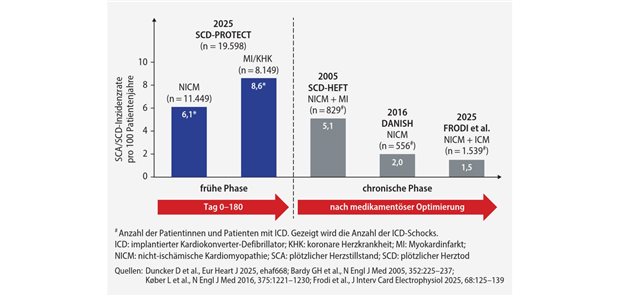
Herzinsuffizienz
Dualer Wirkstoff LCZ696 erhält US-Zulassung
Die bislang als LCZ696 bekannte Valsartan/Sacubitril-Kombination ist von der Arzneimittelbehörde FDA in den USA zur Therapie bei Herzinsuffizienz zugelassen worden. Die Entscheidung über die EU-Zulassung wird in Kürze erwartet.
Veröffentlicht:NEU-ISENBURG. LCZ696 soll in den USA unter dem Warenzeichen Entresto auf den Markt kommen. Es handelt sich um eine auch als ARNI (Angiotensin-Rezeptor-Neprilysin-Inhibitor) bezeichnete Substanz mit dualer Wirkung.
Sie enthält in einer Tablette sowohl den AT1-Rezeptorblocker Valsartan als auch den Neprilysin-Hemmer Sacubitril. Wissenschaftliche Basis für die jetzt erteilte US-Zulassung sind die Mitte 2014 beim Kongress der ESC in Barcelona erstmals vorgestellten Ergebnisse der Studie PARADIGM-HF, die für große Aufregung unter den Herzinsuffizienz-Experten gesorgt haben.
PARADIGM-HF ist mit 8442 beteiligten Patienten die bislang größte Studie, in der ein neues Pharmakon bei der Indikation Herzinsuffizienz auf Wirksamkeit und Sicherheit geprüft worden ist.
Referenzsubstanz war in dieser Studie der ACE-Hemmer Enalapril, dessen prognostischer Nutzen bei Herzinsuffizienz in placebokontrollierten Studien dokumentiert ist. LCZ696 erwies sich in praktisch allen klinischen Belangen dem ACE-Hemmer als deutlich überlegen.
So wurden die kardiovaskuläre Mortalität und die Rate der durch Herzinsuffizienz bedingten Krankenhauseinweisungen durch LCZ696 im Vergleich zu Enalapril signifikant reduziert.
Beschleunigte Prüfung auch in EU Ebenso wie die FDA hat auch der Europäische Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde EMA LCZ696 ein beschleunigtes Prüfverfahren gewährt.
Das bedeutet, dass der CHMP seine Entscheidung bereits nach 150 Verfahrenstagen anstatt der üblichen 210 Tage bekannt geben kann. LCZ696 ist das erste in der klinischen Prüfung befindliche Herz-Kreislauf-Medikament, das von der EMA den Vorzug einer beschleunigten Prüfung durch die Behörde erhalten hat.
Hierdurch verkürzt sich der formale Ablauf um 60 Tage. Das Dossier zur Beantragung der Marktzulassung ist Anfang 2015 eingereicht worden. Vermutlich wird somit auch die Entscheidung über die EU-Zulassung für LCZ696 nicht mehr lange auf sich warten lassen. (ob)