Im Eilverfahren
FDA prüft Krebs-Kandidat von Merck
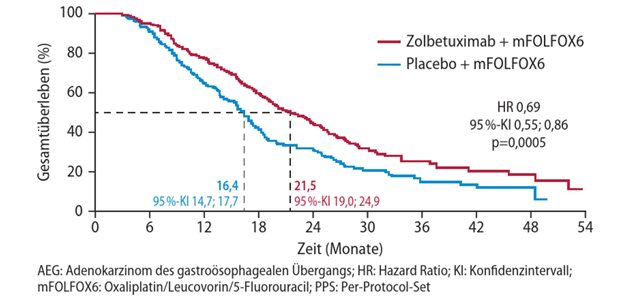
DARMSTADT. Die Merck KGaA, zuletzt von Erfolgen in der Pharmaforschung nicht gerade verwöhnt, hat für den Krebs-Wirkstoff Evofosfamid (zuvor TH-302) in Kombination mit Gemcitabin den Fast-Track-Status der US-Zulassungsbehörde erhalten.
Die FDA beantwortet das Zulassungsgesuch nun innerhalb von nur 60 Tagen.
Erstindikation ist unbehandeltes, metastasiertes oder lokal fortgeschrittenes, inoperables Pankreaskarzinom. Evofosfamid stammt aus der Pipeline der kalifornischen Threshold Pharmaceuticals, mit der Merck 2012 eine Entwicklungsallianz eingegangen war.
Bei dem Wirkstoff handele es sich um eine "Arzneimittelvorstufe, die bei stark ausgeprägtem Sauerstoffmangel des Tumors aktiviert werden soll", heißt es. (cw)