EU-Medizinprodukteverordnung
Liberale sehen Staat bei MDR-Chaos in der Pflicht
Ein „Fast-Track-Verfahren“ für innovative MedTech-Start-ups und einen Plan B zur Bewältigung möglicher Versorgungsengpässe sind nur zwei Maßnahmen, die die FDP-Bundestagsfraktion in einem Antrag von der Bundesregierung im Zuge der Implementierung der novellierten EU-Medizinprodukteverordnung fordert.
Veröffentlicht: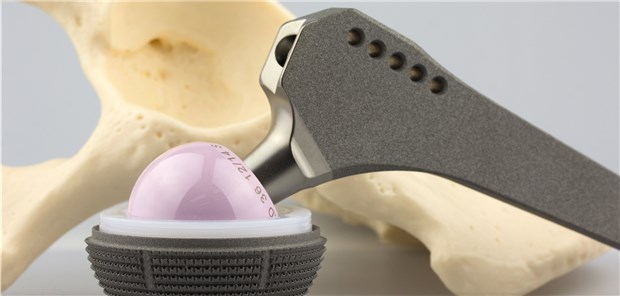
Endoprothesen & Co: Für rund 500.000 Medizinprodukte wird im Zuge der novellierten EU-Medizinprodukteverordnung ein Zulassungsverfahren bei einer Benannten Stelle notwendig.
© julianemartens / stock.adobe.com
Berlin. Die FDP-Bundestagsfraktion sieht immensen Handlungsdruck staatlicherseits, um die deutsche Medizintechnikindustrie – und hier vor allem die kleinen und mittelständischen Unternehmen (KMU), die laut Bundesverband Medizintechnologie (BVMed) 93 Prozent der Branche darstellen – bei der schleppenden Umsetzung der zum 26. Mai dieses Jahres greifenden, novellierten EU-Medizinprodukteverordnung (Medical Device Regulation/MDR) zu begleiten und für Erleichterungen zu sorgen. Entsprechende Forderungen hat sie in einen Antrag in den Bundestag eingebracht.
Besonderer Handlungsbedarf bei Orphan Devices
„Im Interesse der Patientenversorgung ist es zwingend erforderlich, dass sich die Bundesregierung mit Nachdruck für eine zeitnahe juristisch tragfähige Lösung auf deutscher und europäischer Ebene einsetzt. Dies ist besonders wichtig für Medizinprodukte für seltene Erkrankungen (Orphan Devices), wie beispielsweise Herzschrittmacher für kleine Kinder oder seltene Tumorversorgungen“, heißt es von FDP-Seite zur Begründung.
Um Innovationen durch den Bearbeitungsstau bei den Benannten Stellen – diese müssen sich im Zuge der MDR erst rezertifizieren lassen, bevor sie den Zulassungsprozess für Medizinprodukte auf Unternehmensantrag hin starten können – nicht vollständig auszubremsen, bestehe der Bedarf für die Einführung eines „Fast-Track-Verfahrens“, so die Liberalen. Bis dato sind europaweit noch nicht einmal zehn Benannte Stellen rezertifiziert.
500.000 Medizinprodukte betroffen
Und: Angesichts der Tatsache, dass rund 500.000 Medizinprodukte nach dem neuen Rechtsrahmen komplett neu zertifiziert werden müssen, ist die Entstehung eines erheblichen Kapazitätsengpasses absehbar. Gerade deshalb befürchten deutsche MedTech-KMU, dass sie eine Vielzahl von Produkten nicht oder nicht rechtzeitig zertifizieren können.
Durch aktuelle Regelungen zur Umsetzung der MDR werden zuerst bestehende Produkte geprüft. Innovationen von Start-ups sowie KMU hätten dadurch kaum eine Chance, eine Benannte Stelle zu finden oder müssten erhebliche Wartezeiten in Kauf nehmen, warnen die Liberalen. „Um dies zu verhindern ist eine Bereitstellung besonderer Kapazitäten für medizintechnische Innovationen erforderlich“, heißt es im Antrag.
Start des neuen Strategieprozesses Medizintechnik gefordert
Fraktionschef Christian Lindner greift auch das dringende Anliegen der Branche auf, die von der Regierungskoalition im Koalitionsvertrag vorgesehene Fortführung des Strategieprozesses Medizintechnik nun endlich zu realisieren, „um Deutschland als Standort der Gesundheitswirtschaft nachhaltig und zukunftsorientiert aufzustellen. Bislang wurde der neue Strategieprozess Medizintechnik allerdings nicht gestartet. Durch die MDR steht die Medizintechnikbranche vor großen Herausforderungen. Es ist daher dringend ein Neustart des Strategieprozesses geboten“, so die Liberalen in ihrem Antrag.
Die FDP will die Regierung auch auffordern, in Abstimmung mit den Ländern einen Plan B für mögliche, der MDR geschuldete Engpasssituationen bei der Patientenversorgung zu entwickeln. Nötig sei insbesondere eine ausreichend große Zahl von Benannten Stellen zur Zertifizierung der Medizinprodukte einschließlich des notwendigen Personals.
Die FDP will die Regierung auch in die Pflicht nehmen lassen, sich auf europäischer Ebene für eine schnellere MDR-Implementierung einzusetzen. Im Fokus stünden dabei „die volle Funktionsfähigkeit der europäischen Datenbank EUDAMED, harmonisierte Normen sowie das Vorliegen der zwingend notwendigen delegierten und Implementierungsrechtsakte für die MDR.“
Als Orientierungshilfe für die KMU fordern die Liberalen, „auf nationaler Ebene eine Informationskampagne für KMU zu Anforderungen der MDR auf den Weg zu bringen, beispielsweise in Form eines konsolidierten Anforderungskatalogs.“
Tempo auch bei Rechtsakten notwendig
Für Medizintechnik-Unternehmen und Benannte Stellen sei die Verordnung selbst in großen Teilen noch nicht umsetzbar, wie die FDP-Fraktion hinweist. Es fehle immer noch eine Vielzahl rechtlicher und tatsächlicher Voraussetzungen im europäischen Verantwortungsbereich, die vorher erfüllt werden müssten.
„Hierzu gehören elf delegierte Rechtsakte und 32 Durchführungsrechtsakte zur MDR, von denen erst drei verabschiedet worden sind. Vor allem die acht in der Verordnung zwingend vorgeschriebenen sind schnellstmöglich zu verabschieden“, fordern die Liberalen.












