Corona-Vakzine
Flexiblerer Einsatz des BioNTech/Pfizer-Impfstoffs in USA
In den USA ist die Notfallzulassung für den Corona-Impfstoff von BioNTech/Pfizer aktualisiert worden. Nun kann die Vakzine bis zu zwei Wochen bei Temperaturen eines normalen Gefrierfachs transportiert und gelagert werden.
Veröffentlicht: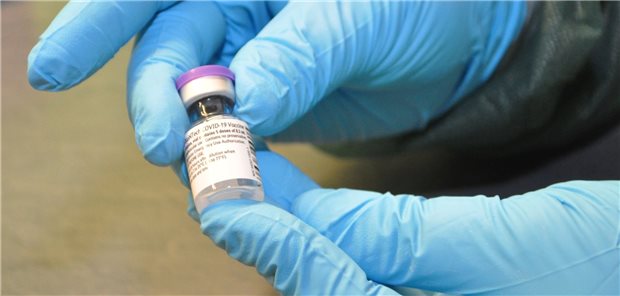
Bisher bei Transport und Lagerung nicht einfach handzuhaben: die Corona-Vakzine von BioNTech/Pfizer.
© Dirk Schnack
Washington / New York / Mainz. Der Corona-Impfstoff der Unternehmen BioNTech und Pfizer darf in den USA ab sofort bis zu zwei Wochen bei Temperaturen eines normalen Gefrierfachs transportiert und gelagert werden. Das wird auch den Einsatz an Orten wie Arztpraxen oder Apotheken vereinfachen.
Die US-amerikanische Lebens- und Arzneimittelbehörde (FDA) erklärte am Donnerstag, die Erlaubnis werde bei der Corona-Impfkampagne für mehr Flexibilität sorgen. Pfizer hatte die Aktualisierung der Notfallzulassung des Impfstoffs hinsichtlich der nötigen Temperatur vor einer Woche beantragt. Parallel dazu wurde informiert, dass die Daten in den nächsten Wochen auch bei anderen Zulassungsbehörden weltweit eingereicht werden sollen.
Bislang musste der Impfstoff bei minus 80 bis minus 60 Grad Celsius transportiert und gelagert werden. Der Hersteller liefert den Impfstoff daher in speziellen Behältern mit Trockeneis aus. Nun sind begrenzt auf zwei Wochen auch Transport und Lagerung im Temperaturbereich von minus 25 bis minus 15 Grad erlaubt.
Zudem ist es nach wie vor erlaubt, den Impfstoff bis zu fünf Tage vor der Verwendung bei Kühlschranktemperatur aufzubewahren.
Dritte Impfung wird getestet
Pfizer und BioNTech haben zudem den Start einer Studie zur Sicherheit und Immunogenität einer dritten Dosis ihrer Vakzine bekannt gegeben. Die Studie soll die Wirkung einer Auffrischungsimpfung auf die Immunität gegen derzeit kursierende und potenziell neuaufkommende SARS-CoV-2-Varianten evaluieren und bis zu 144 Teilnehmer der Phase-I-Studie in den USA in zwei Altersgruppen von 18-55 Jahren und 65-85 Jahren einbeziehen.
Den Studienteilnehmern wird sechs bis zwölf Monate nach Erhalt der Impfung mit zwei Dosen eine zusätzliche dritte Impfung von 30μg verabreicht – unabhängig vom Antikörper-Titer der Person. Die Immunantwort der Teilnehmer wird zum Zeitpunkt der dritten Impfung, sowie nach einer Woche und nach einem Monat gemessen, wie Pfizer und BioNTech mitteilen.
Außerdem soll geprüft werden, ob die Seren der Studienteilnehmer bestimmte SARS-CoV-2-Stämme neutralisieren können. Die Teilnehmer werden, wie ursprünglich geplant, bis zu zwei Jahre lang im Rahmen der Studie weiter beobachtet.
Gespräche mit Zulassungsbehörden laufen
Um auf potenzielle zukünftige Stammänderungen vorbereitet zu sein, befinden sich Pfizer und BioNTech außerdem in laufenden Gesprächen mit den Zulassungsbehörden, einschließlich der FDA und der EMA. Dabei gehe es um eine zulassungsrelevante klinische Studie zur Evaluierung eines variantenspezifischen Impfstoffs mit einer angepassten mRNA-Sequenz, so die beiden Unternehmen.
Diese Studie würde ein neues Konstrukt des Pfizer/BioNTech-Impfstoffs testen, das auf der B.1.351-Linie basiert, die erstmals in Südafrika identifiziert wurde. Die Studie könnte es Pfizer und BioNTech ermöglichen, den aktuellen Impfstoff schnell auf neue Varianten anzupassen.
Die Unternehmen hoffen, dass die Genehmigung zukünftiger angepasster mRNA-Impfstoffe auf einem ähnlichen regulatorischen Weg erfolgen kann, wie es derzeit für Grippeimpfstoffe der Fall ist. Dieses Vorgehen entspricht auch den aktualisierten FDA-Richtlinien zum Notfalleinsatz von COVID-19-Impfstoffen und den darin enthaltenden Empfehlungen zur Evaluierung eines angepassten Impfstoffs gegen Varianten. (dpa/eb)