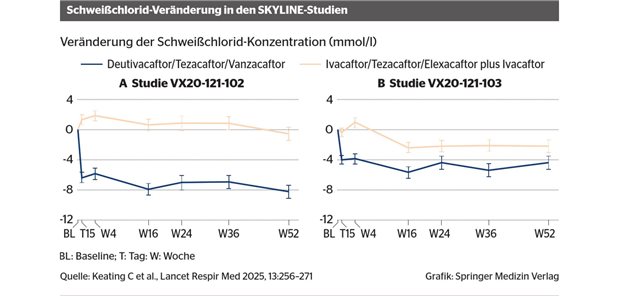
Atmungskette
Proteinkomplex entschlüsselt
FRANKFURT/MAIN. Die Struktur des größten Proteins der Atmungskette, des mitochondrialen Komplex I, haben Wissenschaftler des Frankfurter Exzellenzclusters "Makromolekulare Komplexe" in Zusammenarbeit mit der Universität Freiburg jetzt mithilfe der Röntgenstrukturanalyse aufgeklärt, teilt die Uni Frankfurt mit ( Science 2015; 347: 44-49).
"Der mitochondriale Komplex I spielt bei der Gewinnung von zellulärer Energie eine Schlüsselrolle und wird darüber hinaus mit der Entstehung von Krankheiten wie Parkinson in Verbindung gebracht", wird Volker Zickermann, Privat-Dozent im Institut für Biochemie II der Goethe-Universität, in der Mitteilung zitiert.
Für das Funktionieren der Atmungskette müssen in allen Zellen unseres Körpers permanent ausreichende Mengen an Sauerstoff zur Verfügung stehen. Die bei der biologischen Oxidation freigesetzte Energie wird dazu verwendet, Protonen von einer Seite der inneren Mitochondrien-Membran auf die andere Seite zu transportieren.
Der entstehende Protonengradient ist die eigentliche "Batterie" für die ATP-Synthese.Was die Forscher überraschte: Frühere Studien legten nahe, dass Redoxreaktion und Protonentransport im Komplex I räumlich voneinander getrennt ablaufen.
Die Wissenschaftler in der Arbeitsgruppe von Zickermann sowie die Arbeitsgruppen von Prof. Harald Schwalbe und Prof. Ulrich Brandtkonnten nun aus der detaillierten Analyse der Struktur ableiten, wie die beiden Prozesse miteinander in Verbindung stehen, so die Uni.
Damit leisten sie einen wichtigen Beitrag zum Verständnis eines elementaren Vorgangs im Energiestoffwechsel.Schon länger sei bekannt, dass Komplex I reversibel zwischen einer aktiven und einer inaktiven Form hin und her wechseln kann, heißt es in der Mitteilung.
Dies werde als ein Schutzmechanismus gegen die Bildung von schädlichen Sauerstoffradikalen interpretiert. Die Struktur gebe nun deutliche Hinweise darauf, wie sich diese beiden Formen voneinander unterscheiden und ineinander überführt werden können.
Die Forschungsergebnisse gäben damit auch wichtige Hinweise zu den molekularen Grundlagen einer pathophysiologisch bedeutsamen Eigenschaft von Komplex I, die etwa für das Ausmaß einer Gewebeschädigung nach einem Herzinfarkt von Bedeutung ist. (eb)