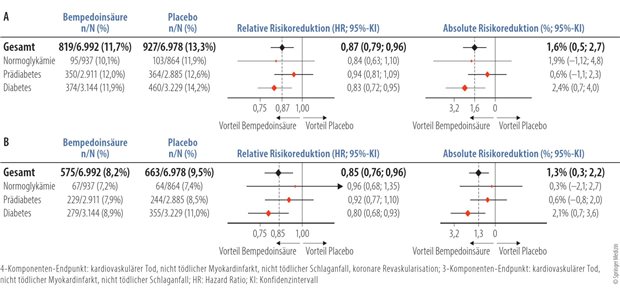
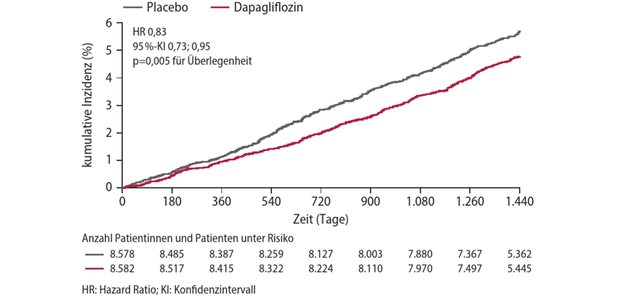
Zulassungsantrag für Kanalblocker bei MS
NEU-ISENBURG (eb). Für das Präparat Fampridine wurde jetzt bei der EU-Zulassungsbehörde EMEA die Zulassung zur Verbesserung der Gehfähigkeit von Patienten mit Multipler Sklerose beantragt. Wie das Unternehmen Biogen Idec mitteilt, ist der selektive Kaliumkanalblocker, der oral verabreicht wird, in den USA bereits seit Beginn des Jahres zugelassen und wird dort von Acorda Therapeutics vermarktet. Die Verbesserung der Gehfähigkeit von MS-Patienten unter Fampridine sei in zwei Phase-III-Studien nachgewiesen worden. Die europäische Zulassung erwartet Biogen Idec im kommenden Jahr.