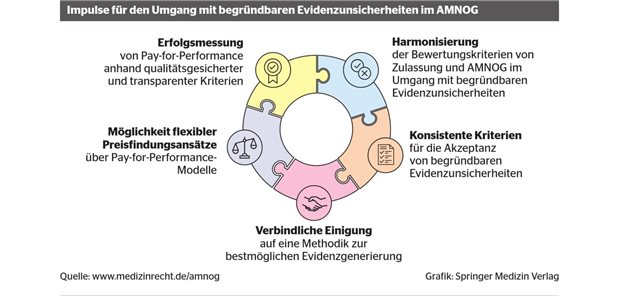
EU-Health Technology Assessment
Arzneimittel und Medizinprodukte: Klinische Bewertung künftig auf europäischer Ebene
EU-Parlament und Rat finden nach monatelangem Ringen einen Kompromiss im Streit um klinische Bewertungen von Arzneimitteln und Medizinprodukten auf EU-Ebene.
Veröffentlicht:
Künftig soll eine Koordinierungsgruppe aus Vertretern der EU-Mitgliedstaaten neue Arzneimittel bewerten. Wie stark die EU-Länder durch die Ergebnisse gebunden sein sollen, war lange umstritten.
© Scanrail / stock.adobe.com
Brüssel. Bei dem seit Jahren umstrittenen Vorhaben einer EU-weiten klinischen Bewertung von Arzneimitteln und Medizinprodukten (Health Technology Assessment, HTA) stehen alle Signale jetzt auf Grün.
Das EU-Parlament und der Europäische Rat – das Dachorgan der Staats- und Regierungschefs – einigten sich am Dienstag auf einen Kompromiss. Diese Einigung muss nun noch in Parlament und Rat formell bestätigt werden.
Die portugiesische Ratspräsidentschaft hatte im März einen Vorschlag auf den Tisch gelegt, der seither intensiv zwischen allen Akteuren beraten wurde. Entsprechend euphorisch äußerte sich Marta Temido, die Gesundheitsministerin Portugals: Patienten, Hersteller und die Gesundheitssysteme der Mitgliedstaaten profitierten, wenn innovative, sichere und effiziente Produkte schneller verfügbar seien. Vertiefte Zusammenarbeit der EU-Staaten mache das möglich.
Steutel: EU-HTA kann Meilenstein werden
Auch der Verband forschender Arzneimittelhersteller (vfa) zeigte sich optimistisch. Die europäische Zulassung von Arzneimitteln sei ein Meilenstein im Gesundheitssektor gewesen, sagte vfa-Präsident Han Steutel der „Ärzte Zeitung“: „Und die europäische Nutzenbewertung kann der nächste werden!“
Der Verband bezeichnete den erreichten Kompromiss als „großen Schritt in die richtige Richtung“. „Für uns war immer klar, dass ein Belgier nicht anders krank ist als ein Portugiese“, so Steutel. Daher müsse der Nutzen der Medikamente auch europaeinheitlich bestimmt werden.
Der vfa-Präsident nannte es richtig, dass man in der EU auf die praktischen Erfahrungen der nationalen Bewertungsinstanzen – in Deutschland ist dies der Gemeinsame Bundesausschuss – zurückgreifen wolle. „Diese müssen jetzt ihr ganzes Augenmerk darauf richten, klare Kriterien und berechenbare Verfahren zu etablieren“, mahnte Steutel.
Preisfindung bleibt Sache der Mitgliedsstaaten
Denn im Vergleich zum ursprünglichen Verordnungsentwurf der EU-Kommission vom Januar 2018 haben sich deutliche Änderungen ergeben:
Mitgliedsstaaten entsenden Vertreter in den künftigen Koordinierungsausschuss (Member State Coordination Group), in dem die klinische Bewertung eines neuen Arzneimittels vorgenommen wird. Ihre Ergebnisse beschreiben nur die vorgelegte Evidenz, die Bewertung – und die Preisfindung – bleibt ausschließlich Sache der HTA-Agenturen in den Mitgliedsstaaten. Betont wird in dem Kompromisspapier, dass die nationalen Vertreter unparteilich und unabhängig zu sein haben. Die Koordinierungsgruppe ist gehalten, Verbände und Interessengruppen – auch Vertreter von Patienten – umfassend zu konsultieren.
Lange wurde darum gerungen, inwiefern die Ergebnisse der Koordinierungsgruppe verbindlich sein sollen für nationale HTA-Agenturen. Insbesondere Länder mit bereits ausgefeilten Prozessen der Nutzenbewertung drangen darauf, wenn nötig auch ergänzende nationale Bewertungen vornehmen zu können.
Der nun gefundene Kompromiss schreibt eine Übergangsfrist von drei Jahren nach Inkrafttreten der Verordnung vor – danach sollen die neuen Regelungen unmittelbar gültig werden. „Das EU-Parlament hat in den Verhandlungen dafür gesorgt, dass die Ergebnisse der gemeinsamen Bewertungen in den Mitgliedsstaaten nicht ignoriert werden können“, sagte Tiemo Wölken, Berichterstatter und SPD-Abgeordneter im EU-Parlament.
Angesichts von EU-weit rund 50 HTA-Agenturen war es der pharmazeutischen Industrie wichtig, dass der Verwaltungsaufwand für Bewertungsprozesse reduziert wird. Unternehmen müssen künftig im Rahmen des HTA-Verfahrens Daten und Studien nur einmal in eine digitale Plattform auf EU-Ebene einspeisen. Parlaments-Berichterstatter Wölken prognostizierte durch das geplante Verfahren eine „dramatische“ Abnahme von Doppelarbeit.
EU-Gesundheitskommissarin Stella Kyriakides zeigte sich überzeugt, ein gemeinsames HTA-Verfahren werde von entscheidender Bedeutung sein mit Blick auf das Ziel einer „Gesundheitsunion“.