PEI gibt grünes Licht
Gentherapie bei SMA nun auch für Babys in Deutschland
Der Schweizer Pharmakonzern Novartis will 100 Dosen seiner Gentherapie bei SMA kostenlos an Kinder in Ländern abgeben, in denen Zolgensma® noch keine Zulassung hat. Jede Einzeldosis kostet rund 2 Millionen Euro. Auch Babys aus Deutschland kommen nun als Teilnehmer infrage.
Veröffentlicht: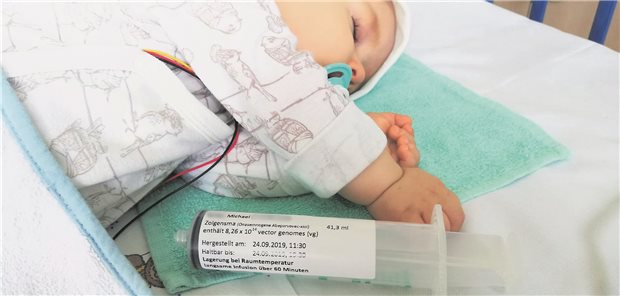
Der einjährige Michael schläft, während er eine Injektion mit dem Genpräparat Zolgensma® gegen spinale Muskelatrophie bekommt.
© Marina Mantel/dpa
Langen/Basel. Bei der kostenlosen Abgabe der Einmal-Gentherapie von Novartis/Avexis für Babys mit spinaler Muskelatrophie (SMA) haben jetzt auch Kinder in Deutschland eine Chance. Am Montag hat das zuständige Bundesinstitut, das Paul-Ehrlich-Institut (PEI) in Langen, grünes Licht gegeben. Das Programm soll in Ländern gelten, in denen das Präparat noch nicht zugelassen ist. Die Vergabe der Gentherapie erfolgt letztlich per Los.
Das Schweizer Pharmaunternehmen Novartis hat sein globales Härtefallprogramm einer Behandlung mit Zolgensma® für 100 Kinder am Montag gestartet. Bei Zolgensma® (Onasemnogene abeparvovec-xioi) handelt sich um das bislang teuerste Medikament der Welt, mit rund zwei Millionen Euro für eine Einmal-Infusion.
Alternative Therapie darf nicht in Frage kommen
Die Therapie ist bei Kindern unter zwei Jahren indiziert, die an SMA mit 5q-Spinaler Muskelatrophie (SMA) mit genetisch bestätigten bi-allelen Mutationen im SMN1-Gen und bis zu 2 Kopien des SMN2-Gens leiden.
Weitere Auswahl-Kriterien für das Härtefallprogramm sind nach Unternehmensangaben der Schweregrad der Erkrankung, der Beginn der Symptome oder eine vorherige Behandlung, die mit momentan verfügbarer Therapie nicht zufriedenstellend ist – das heißt, ein unbefriedigendes Ergebnis mit der angewendeten Therapie nach angemessener Zeit oder Patienten, die für die derzeitige Behandlung medizinisch nicht in Frage kommen. Unbehandelt kann SMA bekanntlich in schweren Fällen zum Tod führen.
Nur auf Vorschlag des behandelnden Neuropädiaters
Eine weitere Bedingung für die Aufnahme in das Programm ist, dass der behandelnde Arzt den Patienten vorschlägt. Den Antrag zur Teilnahme am globalen Auswahlverfahren dieses Programms könne nur ein erfahrener Neuropädiater an einem zertifizierten Muskelzentrum stellen, wenn die medizinischen Einschlusskriterien erfüllt seien, so das Unternehmen.
„Es gibt keine Gründe, dem Härtefallprogramm zu widersprechen“, teilte das PEI mit. Das Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel ist dafür zuständig, solche Ausnahmeregeln zu genehmigen. Damit können Kinder, die das Los trifft, auch in Deutschland mit dem Medikament Zolgensma® behandelt werden, obwohl es in Europa noch nicht zugelassen ist.
Kritik an dem Verfahren
Im Vorfeld hatte es bereits Kritik an der Initiative des Unternehmens gegeben. Die Therapie sollte nach medizinischen Kriterien für jene Kinder zur Verfügung stehen, die sie am nötigsten brauchen, hieß es. Auch von gesetzlichen Krankenkassen kam Kritik an dem Verfahren. In Deutschland ist nach Angaben des Instituts eins von 10.000 Kindern betroffen.
Novartis führt gegen die Kritiker an, dass sein Tochterunternehmen AveXis ein Programm entwickelt habe, das „auf den Prinzipien der Fairness, des klinischen Bedarfs und der globalen Zugänglichkeit“ beruhe, um die gerechte globale Verteilung einer begrenzten Anzahl von Dosen, die kein Kind oder Land gegenüber einem anderen begünstigt, am besten zu bestimmen. Zum aktuellen Zeitpunkt sei nur ein Werk für die Produktion von Onasemnogene abeparvovec-xioi lizensiert. Daher seien die Produktionskapazitäten noch begrenzt. Im Jahr 2019 seien insgesamt nur etwa 200 Kinder behandelt worden.
Bislang gebe es auch keine Vorschläge für Alternativen zur Vergabe der Gentherapien im Härtefallprogramm, so das Unternehmen.
Das Medikament ist in den USA seit Mai vergangenen Jahres zugelassen. In Europa laufen noch Prüfungen durch die Europäische Arzneimittelagentur (EMA). Das Unternehmen erwartet die Zulassung noch im ersten Halbjahr 2020. Bisher steht in Deutschland außerdem bekanntlich alternativ das Antisenseoligonukleotid Nusinersen für SMA-Patienten zur Verfügung. (ger/dpa)