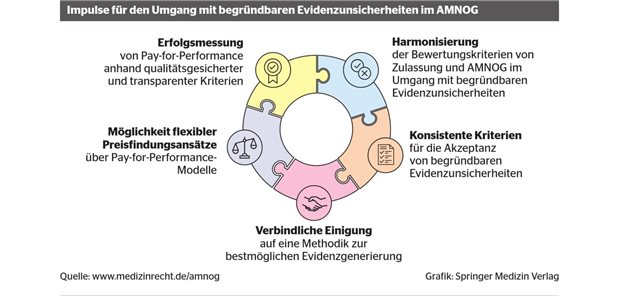
LONDON (brs). Arzneimittel können in der EU auch zentral zugelassen werden, wenn zum Zeitpunkt der abschließenden Bewertung nicht alle sonst erforderlichen klinischen Daten vorgelegt werden. Diese "Genehmigung vorbehaltlich besonderer Bedingungen" kann gewährt werden für Arzneimittel gegen lebensbedrohliche oder seltene Krankheiten sowie für Medikamente für Krisensituationen.
Die Zulassung ist zeitlich zunächst auf ein Jahr begrenzt und sie ist an die Bedingung geknüpft, dass der Hersteller die Daten innerhalb einer bestimmten Zeit nachreicht, also zum Beispiel noch ausstehende Studien abschließt.