DGHO-Bilanz
26 CAR-T-Zentren und bisher weniger Patienten als erwartet
Eines der avanciertesten onkologischen Therapieverfahren, die Behandlung mit modifizierten autologen T-Zellen, hat zwei Jahre nach Erstzulassung in Deutschland flächendeckend Fuß gefasst.
Veröffentlicht: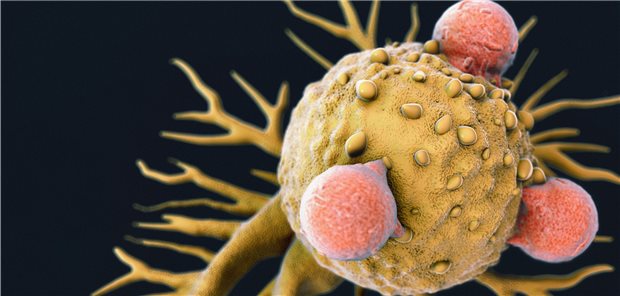
Bei der CAR-T-Zelltherapie werden Krebszellen (gelb) mittels gentechnisch veränderten T-Zellen (rot) abgetötet.
© luismmolina / Getty Images / i
Heidelberg. Erheblich weniger Patienten als erwartet – aber auch weniger Komplikationen im Versorgungsalltag als von vielen Experten zunächst befürchtet: So lautet eine erste Bilanz nach zwei Jahren CAR-T-Zelltherapie in Deutschland, wie sie unlängst von der Deutschen Gesellschaft für Hämatologie und Medizinische Onkologie (DGHO) gezogen wurde.
Zur Erinnerung: Im August 2018 hatte die EU-Kommission taggleich die zwei ersten CAR-T-Therapien europaweit zugelassen, Yescarta® (Axicabtagene ciloleucel) der Gilead-Tochter Kite und Kymriah® (Tisagenlecleucel) von Novartis. Beide Produkte werden gegen verschiedene B-Zell-Lymphome eingesetzt. Dabei werden autologe T-Zellen ex vivo genetisch so verändert, dass sie CD19 erkennen, ein Oberflächenprotein von B-Lymphozyten. Die modifizierten T-Zellen werden dem Patienten anschließend reinfundiert und sollen dann CD19-tragende Zellen gezielt angreifen und zerstören können.
Verträge mit beiden Anbietern
Inzwischen gebe es bundesweit 26 Zentren, berichtet die DGHO, die auf Grundlage entsprechender Verträge mit den Herstellern CAR-T-Therapien anbieten können. Die meisten Zentren hätten Verträge mit beiden Herstellern geschlossen. Wie ein Blick auf die Landkarte zeigt, erstreckt sich das Zentren-Angebot relativ gleichmäßig von Kiel im Norden bis Freiburg und München im Süden über die gesamte Republik. Mit dieser flächendeckenden Ausstattung kann Deutschland derzeit die höchste Anbieterdichte in Europa vorweisen und hebt sich damit erkennbar von seinen Nachbarn ab; nach Darstellung der DGHO kommt Frankreich derzeit auf lediglich fünf Zentren, Italien auf vier, UK und Spanien ebenfalls auf jeweils fünf.
Stand Mai dieses Jahres haben den Angaben zufolge erst 342 Patienten hierzulande eine CAT-T-Therapie erhalten. Im Rahmen der frühen Nutzenberwertung sei dagegen mit jährlich etwa 600 Patienten mit aggressivem B-Lymphom und 50 bis 65 Patienten mit B-Linien-ALL gerechnet worden. Laut einer Umfrage der Fachgesellschaft bei den Zentren erwartet allerdings etwas mehr als die Hälfte (15), dass die Patientenzahlen in den kommenden Monaten noch steigen.
342 Patienten wurden seit EU-Zulassung der CAR-T-Therapien Yescarta® und Kymriah® im Herbst 2018 mit einem dieser beiden Produkte in Deutschland bisher behandelt (Quelle: DGHO, Stand Mai 2020).
Unterdessen relativiert sich die Sorge vor schwerwiegenden Nebenwirkungen, wie sie in der Einführungsphase der CAR-T-Therapien bestand. „Die tatsächliche Rate der intensivpflichtigen Patienten liegt bei 14 Prozent und ist damit deutlich niedriger als initial erwartet. Die Sterblichkeitsrate liegt bei drei Prozent“, berichtet die DGHO unter Verweis auf ihre Umfrage.
Pauschale reicht vielen nicht
Auch anfängliche administrative und organisatorische Reibungsverluste bekäme man immer besser in den Griff, heißt es. Dadurch sei es möglich, die Therapie „wirtschaftlicher durchzuführen“. Trotzdem brenne den Zentren die Kostenfrage noch auf den Nägeln. Zwischen Deutscher Krankenhausgesellschaft und GKV-Spitzenverband seien 15.000 Euro Pauschalhonorar für die CAR-T-Therapie vereinbart worden, das der Umfrage zufolge aber von vielen Zentren (18) als nicht kostendeckend erachtet wird. Auch nach den Auswirkungen der Corona-Krise auf die CAR-T-Therapie hatte die DGHO bei ihrer Mai-Erhebung gefragt. Danach zog bis dato die Pandemie nahezu spurlos am Versorgungsalltag vorbei; nur drei Zentren bejahten die Frage, ob COVID-19 sie bei der Leistungserbringung beeinträchtigt habe.
Drittes Produkt in Sicht
Als drittes CAR-T-Produkt in Europa wird nun eine Zelltherapie für Patienten mit Multiplem Myelom erwartet, Idecabtagen vicleucel des US-Unternehmens Celgene (Konzernmutter: Bristol-Myers Squibb); unlängst wurden zulassungsrelevante Daten vorgestellt. Auch ein Zulassungsantrag für Idecabtagen vicleucel ist bei der europäischen Arzneimittelagentur EMA schon anhängig. Seitens der DGHO rechnet man mit einem positiven Bescheid „spätestens Anfang nächsten Jahres“.