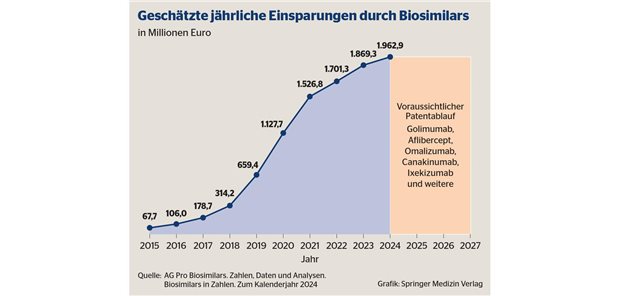
Medizinprodukte
Spectaris hadert mit Zentralisierung
BERLIN. Nachdem das Bundesministerium für Gesundheit kürzlich den Entwurf für ein Medizinprodukte-Anpassungsgesetz-EU (MPAnpG-EU) vorgelegt hat, wonach die Risikobewertung und Kontrolle von Medizinprodukten bei den zuständigen Bundesbehörden gebündelt werden soll, hat nun der Branchenverband Spectaris darauf reagiert.
Er befürchtet, durch die Verlagerung von Zuständigkeiten könnte es zu weiteren Engpässen kommen. Bislang waren Länderbehörden für Risikobewertung und Kontrolle von Medizinprodukten verantwortlich. Zukünftig sollen das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) und das Paul Ehrlich Institut (PEI) diese Aufgaben übernehmen.
Der Gesetzesentwurf sieht eine Zentralisierung auf diese beiden Bundesbehörden vor. „Von neun Abteilungen ist gerade mal eine Abteilung im BfArM für den Bereich der Medizinprodukte zuständig. Es drängt sich die Frage auf, wie eine Abteilung allein die bisherige Arbeit zahlreicher Landesbehörden nahtlos bewerkstelligen soll“, kritisiert Spectaris-Geschäftsführer Jörg Mayer.
Laut Entwurf des Gesundheitsministers soll das BfArM zudem ermächtigt werden, unter bestimmten Voraussetzungen Inverkehrbringen und Inbetriebnahme von Medizinprodukten in Deutschland gesondert zu genehmigen. Die nationalen Sonderregelungen lösten jedoch nicht die Probleme im Zuge der novellierten EU-Medizinprodukteverordnung, so Mayer.
Die sieht ab 26. Mai 2020 neue Zulassungsregeln vor. EU-weit gibt es jedoch erst vier Benannte Stellen, die entsprechend dem neuen EU-Recht zertifiziert sind. Spectaris plädiert daher dafür, „Übergangsfristen praktikabler zu gestalten und die Engpässe rund um die Benannten Stellen mit aller Kraft zu beseitigen“. (mu)