Phase IIa-Studie
Mit Stammzellen gegen chronisch-venöse Ulzera
Heidelberg. ABCB5-positive mesenchymale Stammzellen (ABCB5+ MSCs) könnten eine neue Therapieoption für Patienten mit chronisch-venösen Ulzera werden. Das legen Ergebnisse einer klinischen Phase IIa-Studie nahe, auf die das auf Stammzelltherapien spezialisierte Unternehmen RHEACELL hinweist.
Die Studie bestätige die Sicherheit und liefere erste Wirksamkeitsdaten der Anwendung ABCB5-positiver Stammzellen bei diesen Patienten, teilt das Heidelberger Biopharma-Unternehmen mit. „ABCB5“ steht dabei für eine Gruppe von Membranproteinen, die ATP binden und Moleküle durch die Membran transportieren können (ABC = ATP binding cassette). Lokal aufgetragene, hochreine ABCB5+ MSCs interagierten mit dem Immunsystem lokal und versetzten so den Körper in die Lage, die chronische Wunde zu schließen, teilt RHEACELL mit. Bei circa 70 Prozent der Patienten sei während der Studie das chronisch venöse Ulkus durchschnittlich um 82 Prozent abgeheilt, in manchen Fällen sogar komplett.
Als Ausgangsmaterial für die ABCB5+ mesenchymalen Stammzellen dient menschliche Spenderhaut. Mit einem patentierten Verfahren können die hochreinen Stammzellen in großem Umfang vervielfacht, zuverlässig isoliert und somit als hochreines, homogenes Zelltherapeutikum (highly functional manufactured stem cells = H.F.M Stem Cells)produziert werden. Die ABCB5+ MSCs seien als neuartiges Zelltherapeutikum (ATMP) klassifiziert, welches unter GMP gemäß §13 Absatz 1 des Arzneimittelgesetzes (AMG) kontrolliert hergestellt wird, berichtet das Unternehmen.
Die klinische Studie wurde multizentrisch in Deutschland durchgeführt. Nachdem die Wirksamkeit und gute Verträglichkeit der Stammzellen nachgewiesen wurden, sollen nun die gewonnenen Daten für die weitere Entwicklung des Medikaments genutzt werden, heißt es in der Mitteilung. Eine klinische Folgestudie sei bereits in Vorbereitung.
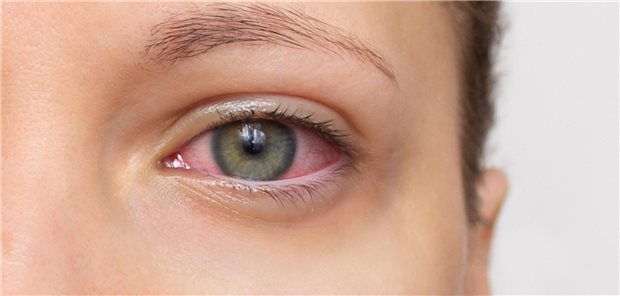
RHEACELL halte den Orphan-Drug- Status durch die Europäische Arzneimittel-Behörde (EMA) und die US-amerikanischen Gesundheitsbehörde (FDA) für die Behandlung von Epidermolysis Bullosa (EB) und für die Limbale Stammzellendefizienz (LSCD). Von der FDA habe RHEACELL auch den „Fast Track Status“ für die LSCD erhalten. Aktuell sucht RHEACELL, ein gemeinsames Unternehmen der Müller Holding und der TICEBA, Investoren oder Partner für die erfolgreiche Durchführung der nächsten klinischen Entwicklungsphasen bis zur Zulassung. (mal)
Quelle: Mitteilung der RHEACELL GmbH & Co. KG; Heidelberg