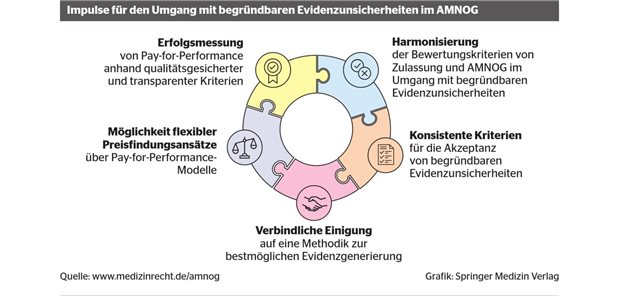
Europäische Arzneimittelagentur
EU-Parlament und Rat einig über mehr EMA-Kompetenzen
Als eine der Lehren aus der Corona-Pandemie soll die Europäische Arzneimittelbehörde schlagkräftiger werden, um Arznei-Engpässe zu verhindern.
Veröffentlicht:
Die Europäische Arzneimittelagentur in Amsterdam soll aufgewertet werden, um in Gesundheitskrisen schlagkräftiger agieren zu können.
© Robin Utrecht/picture alliance
BRÜSSEL. Die Europäische Arzneimittelbehörde EMA soll auf Gesundheitskrisen wie die Corona-Pandemie in Zukunft schlagkräftiger reagieren können. Unterhändler des Europaparlaments und der EU-Staaten einigten sich am Donnerstag darauf, das Mandat der Behörde in Amsterdam zu stärken.
Denn insbesondere in der Frühphase der Pandemie verfügte die EU über keine gemeinsamen Kompetenzen und Werkzeuge, um Engpässe bei Beatmungsgeräten, Schutzkleidung oder Testkits zu mindern. Auch konnte die EMA keine koordinierten Empfehlungen zur Behandlung oder Prävention von COVID-19 formulieren, da sie keinen ausreichenden Zugang zu Daten hatte.
Die geplante Verordnung ist Teil eines Maßnahmenpakets, mit dem die EU-Kommission auf die Erfahrungen während der Corona-Pandemie reagieren will. Dazu gehören auch umfassendere Kompetenzen für die EU-Seuchenschutzbehörde ECDC sowie eine neue, bei der EU-Kommission angesiedelte Behörde für Krisenvorsorge und -reaktion bei gesundheitlichen Notlagen (Health Emergency Preparedness und Response Authority, HERA). Diese hat bereits Anfang Oktober ihre Arbeit aufgenommen.
Liste kritischer Arzneimittel
Neu etabliert werden soll mit der Verordnung eine Lenkungsgruppe bei der EMA, die sich möglichen Engpässen bei Arzneimitteln und Medizinprodukten widmet. Diese soll regelmäßig tagen, nicht nur im Vorfeld oder während sogenannter Notlagen für die öffentliche Gesundheit. Das Gremium soll eine Liste „kritischer Arzneimittel“ erstellen und Informationen über deren Lagerbestände sammeln.
Auf Anfrage müssen die Hersteller dieser Medikamente Informationen über absehbare Engpässe zur Verfügung stellen. Das EU-Parlament drängte in den Verhandlungen mit den Vertretern der Mitgliedsstaaten darauf, dass bei den Mitgliedern der Lenkungsgruppe keine Interessenskonflikte vorliegen dürfen, die ihre Unparteilichkeit einschränken könnten. Beratungen und Empfehlungen des Gremiums sollen öffentlich gemacht werden.
Eingesetzt hat sich das Europaparlament auch für eine webbasierte Plattform, auf der Informationen über Engpässe bei Arzneimitteln und Medizinprodukten eingestellt werden.
Zugriff auf Studienergebnisse
Im Fall einer gesundheitlichen Notlage – ähnlich wie während der Corona-Pandemie – kann die EMA künftig forschende Pharmaunternehmen bei der Entwicklung von dringend benötigten Arzneimitteln im Rahmen von klinischen Studien unterstützen.
Dies soll helfen, den Zeitraum zwischen der Vorlage von Studienergebnissen und der Zulassung zu verkürzen. Dazu kann die EMA im Bedarfsfall auch auf Studienprotokolle und auf Ergebnisse klinischer Studien zugreifen.
„Die Vorbereitung und die Koordinierung auf EU-Ebene sind zwei wesentliche Faktoren für die Bewältigung künftiger Gesundheitskrisen“, betonte der slowenische Gesundheitsminister Janez Poklukar im Namen der derzeitigen EU-Ratspräsidentschaft.
Der spanische Sozialdemokrat Nicolás González Casares, der für das Parlament verhandelt hatte, sagte, dass es durch das neue Mandat „mehr Transparenz, mehr Beteiligung, mehr Koordination, mehr wirksame Überwachung und mehr Vorsorge“ durch die EMA gebe.
Die Einigung vom Donnerstag muss noch vom Rat der EU-Staaten sowie vom EU-Parlament bestätigt werden. (fst/dpa)