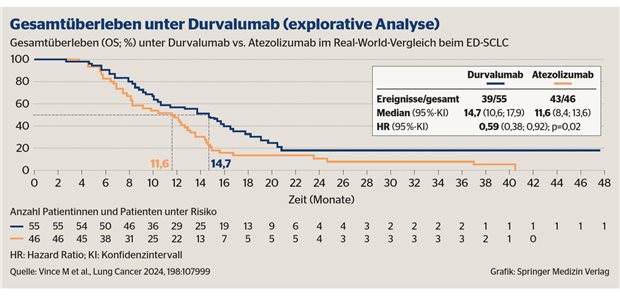
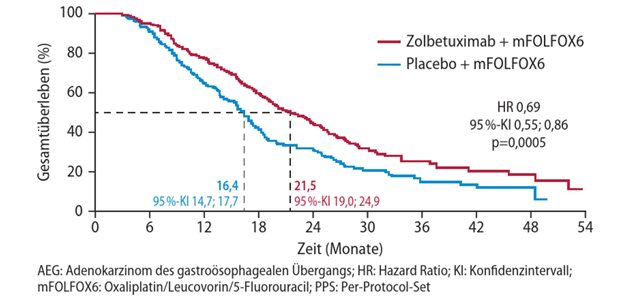
Bevacizumab-Biosimilar
Servier stärkt Portfolio in der Onkologie
München. Das Bevacizumab-Biosimilar Alymsys® hat vor Kurzem die Zulassung der Europäischen Kommission zur Behandlung verschiedener Tumorentitäten erhalten. Servier hat das Biosimilar dank der engen Kooperation mit dem spanischen Biotechnologie-Unternehmen mAbxience auf den Markt gebracht. Als Vertriebspartner übernimmt die Servier Deutschland GmbH damit Vermarktung und Vertrieb in Deutschland.
Das Biosimilar hat Bioäquivalenz zum Referenzprodukt gezeigt. Bestätigt werden konnten vergleichbare Qualität, Sicherheit und Wirksamkeit. Die Zulassung von Alymsys® bezieht sich auf die Therapie von verschiedenen fortgeschrittenen bzw. metastasierten Karzinomen, für die auch das Referenzprodukt zugelassen ist: kolorektales Karzinom, Mamma-Ca, nicht-kleinzelliges Bronchialkarzinom, Nierenzellkarzinom, epitheliales Ovarialkarzinom, Eileiterkarzinom, primäres Peritonealkarzinom und Zervixkarzinom. Eingesetzt wird Bevacizumab in Kombination mit den jeweils indizierten Chemotherapeutika bzw. anderen zielgerichteten Substanzen.
Bevacizumab ist ein rekombinanter, humanisierter monoklonaler Antikörper gegen den vaskulären endothelialen Wachstumsfaktor (VEGF). Der Antikörper hemmt die Bindung von VEGF an dessen Rezeptoren auf der Oberfläche von Endothelzellen. Dadurch wird das Signal zur Angiogenese unterdrückt und damit das Tumorwachstum behindert. (eb)
Quelle: Mitteilung der Servier Deutschland GmbH