Menarini Stemline Deutschland GmbH
Brustkrebs mit ESR1-Mutation: Pluspunkte für Elacestrant
Das Antiöstrogen Elacestrant verdoppelt das mediane progressionsfreie Überleben beim lokal fortgeschrittenen oder metastasierten ER-positiven, aber HER2-negativen Brustkrebs.
Veröffentlicht:Der selektive Estrogenrezeptor-Downregulator (SERD) Elacestrant wurde von der Europäischen Kommission zur Behandlung bei lokal fortgeschrittenem oder metastasiertem ER-positivem (ER+)/HER2-negativem (HER2-) Brustkrebs zugelassen, wenn eine aktivierende ESR1-Mutation in den Plasmaproben vorliegt. ESR1-Mutationen sind bei bis zu 40 % der ER+ und HER2- fortgeschrittenen oder metastasierten Mammakarzinome vorhanden und sind die Ursache von Resistenzen gegen die endokrine Standardtherapie.
In der Phase-III-Zulassungsstudie EMERALD waren die Patient*innen zu 100 % mit CDK4/6-Inhibitoren vorbehandelt, was einen großen Einfluss haben könne, betonte Professorin Tanja Fehm vom Universitätsklinikum Düsseldorf.
Medianes progressionsfreies Überleben von 3,8 Monaten
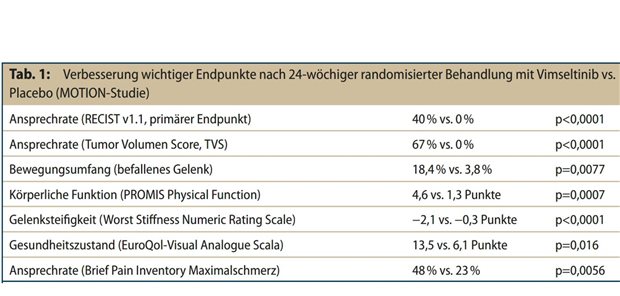
Die primären Endpunkte der Studie waren das mediane progressionsfreie Überleben (mPFS) in der gesamten Patient*innenpopulation und bei Patient*innen mit ESR1-Mutation. In der Gruppe der Patient*innen, deren Tumoren ESR1-Mutationen aufwiesen, erreichte Elacestrant (Orserdu®) ein mPFS von 3,8 Monaten im Vergleich zu 1,9 Monaten bei der Standardtherapie (SOC), also endokriner Monotherapie mit Fulvestrant, Letrozol, Anastrozol oder Exemestan. Ferner verringerte Elacestrant das Risiko für das Fortschreiten der Erkrankung oder Tod um 45% gegenüber SOC, und zwar unter Beibehaltung von guter Lebensqualität (HR:0,55; 95% CI:0,39-0,77).
„Je länger die Vorbehandlung mit einem CDK4/6-Inhibitor dauert, desto länger ist das PFS von Elacestrant im Vergleich zur endokrinen Standardtherapie“, erläuterte Fehm. Bei Patient*innen mit ESR1-Mutation, die vor der Randomisierung bei EMERALD länger als zwölf Monate mit CDK4/6-Inhibitoren behandelt wurden, erreichte Elacestrant ein mPFS von 8,6 Monaten versus 1,9 Monaten bei der Standardbehandlung, was einer absoluten Differenz von 6,7 Monaten entspricht.
Darüber hinaus wurde ein um 59% verringertes Risiko für Progression oder Tod festgestellt (HR=0,41, 95% KI: 0,26-0,63). „Voraussetzung für den Einsatz der neuen Therapieoption ist die Detektion von ESR1-Mutationen“, betonte Fehm. Dies kann wie in der Zulassungsstudie mittels Hybrid Capture NGS (Next-Generation-Sequencing) an Liquid Biopsy-Proben erfolgen. (eim)
Quelle: Pressekonferenz „Erster und einziger in Deutschland zugelassener oraler SERD beim ER+ HER2-Mammakarzinom mit ESR1-Mutation“, November 2023, Frankfurt am Main; Veranstalter: Menarini Stemline Deutschland GmbH