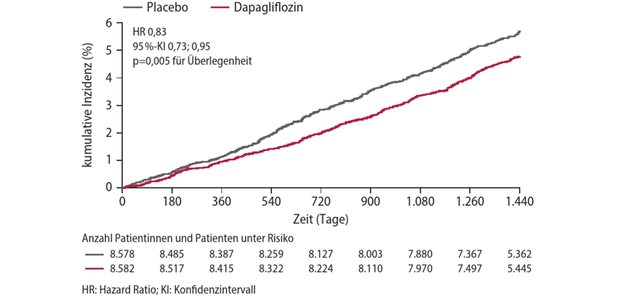
GASTKOMMENTAR
Verständlich, aber überraschend
Vor einem Jahr wurde der Wirkstoff Lumiracoxib (Prexige®) in der Dosierung von 100 mg/Tag zur Therapie von Schmerzen bei Ar-throse zugelassen. Lumiracoxib ist chemisch mit dem Diclofenac verwandt, verfügt aber über eine größere Cyclooxygenase-2-Selektivität als Diclofenac. Das Ruhen der EU-Zulassung von Lumiracoxib erfolgte aufgrund von meist reversiblen Leberschädigungen (Erhöhung der Transaminasen und des Bilirubins). Eine grundlegende Risiko-Nutzenanalyse durch die EMEA steht noch aus.
Anlass der Zulassung von Lumiracoxib war die intensive und langzeitige Erprobung des Wirkstoffes mit dem Befund einer guten analgetischen Wirksamkeit beim weitgehenden Fehlen von gastrointestinalen Ulzera und Blutungen, Blutdruckerhöhung, pseudoallergischen Reaktionen und Blutgerinnungsstörungen. Das Risiko eines (dosisabhängigen) Leberschadens war bei der Zulassung bekannt.
Das Ruhen der Zulassung von Lumiracoxib ist einerseits verständlich (Leberschäden), andererseits überraschend (da dieses Risiko in ähnlicher Weise bei Diclofenac und in stärkerem Umfang bei Anwendung höherer Dosen des rezeptfrei verkauften Paracetamols auftritt). Die erwiesene gute gastrointestinale Verträglichkeit und die schnelle Elimination des Wirkstoffes machen bei einer vergleichenden Risikobeurteilung keineswegs plausibel, dass dieser Wirkstoff verglichen mit anderen auf dem Markt, zum Teil frei verkäuflichen Analgetika, wie ASS (Blutungsrisiko) und Paracetamol (Hepatotoxizität und geringe therapeutische Breite), vom Markt genommen werden muss.
Die Maßnahme muss daher als vorsorglich akzeptiert werden - vorausgesetzt, dass die dringend nötige, vergleichende Risikobewertung aller Cyclooxygenasehemmer, zu denen außer Acetylsalicylsäure, Diclofenac, Ibuprofen und Naproxen auch das Paracetamol und das Metamizol gehören, von den Behörden vorgenommen wird. "Gleiche Standards" muss das Grundprinzip der Bewertung von neuen im Vergleich zu alten, scheinbar bewährten und erprobten Wirkstoffen sein.
Wie leicht man die Gefahren "bewährter" Wirkstoffe unterschätzt, hat die Marktrücknahme von Clobutinol (Silomat®) nach mehr als 40 Jahren zum Teil rezeptfreien Gebrauchs gezeigt.
Kay Brune ist Professor am Institut für Experimentelle und Klinische Pharmakologie und Toxikologie der Universität Erlangen-Nürnberg.