Glybera®
Nutzenbewertung auf Eis gelegt
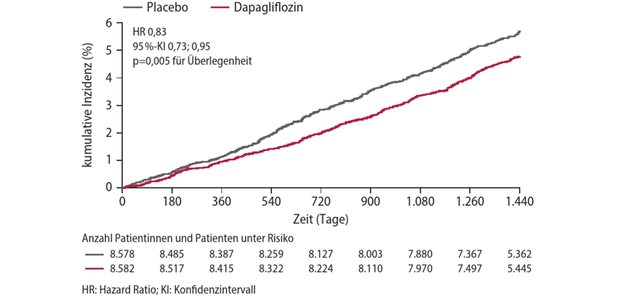
Erstmals seit Einführung der frühen Nutzenbewertung überschreitet der GBA die Bewertungsfrist: Bei Glybera® wurde das Verfahren ausgesetzt.
Veröffentlicht:BERLIN. Patientensicherheit geht vor - mit dieser Begründung hat der Gemeinsame Bundesausschuss (GBA) das Nutzenbewertungsverfahren für Glybera® ausgesetzt.
Das Orphan Drug mit dem Wirkstoff Alipogentiparvovec soll ein negatives Nutzen-Risiko-Verhältnis aufweisen. Das hat der zuständige Berichterstatter bei der Europäischen Arzneimittelbehörde EMA bereits am 8. April mitgeteilt.
Beim GBA seien die Informationen jedoch erst am Mittwoch, 14. April, eingegangen, berichtete der unparteiische Vorsitzende des Gremiums, Professor Josef Hecken, in der Sitzung am Donnerstag in Berlin.
Novum in der frühen Nutzenbewertung
Erstmals seit Beginn der frühen Nutzenbewertung wird der Ausschuss eine gesetzlich vorgegebene Frist nicht einhalten können. Die Bewertung für Glybera® hätte Anfang Mai vorliegen müssen.
Nachdem sich die EMA mit möglichen Folgerungen aus den neuesten Entwicklungen zwischen dem 21. und dem 23. April befassen wird, sei der Termin nicht zu halten, räumte Hecken ein.
Die Sicherheit der an einer seltenen Stoffwechselkrankheit leidenden Patienten habe absoluten Vorrang, beschied Hecken.
Es wäre unverantwortlich, aufgrund der Privilegierung der Orphan Drugs zum gegenwärtigen Zeitpunkt einen Zusatznutzen für den Wirkstoff auszusprechen und damit möglicherweise ein falsches Signal an Patienten und Ärzte auszusenden.
Die Sicherheit gehe vor das Einhalten der Verfahrensfrist. Als Orphan Drug gilt für Glybera® der Zusatznutzen unterhalb der Schwelle von 50 Millionen Euro Umsatz durch die Zulassung als belegt.
Der GBA entscheidet lediglich über das Ausmaß des Nutzens. (af)


![Die Schilddrüse tickt in jedem Lebensalter anders Porträts: [M] Feldkamp; Luster | Hirn: grandeduc / stock.adobe.com](/Bilder/Portraets-M-Feldkamp-Luster-Hirn-grandeduc-stockadobecom-235723.jpg)