DAK-AMNOG-Report 2020
Zehn Jahre AMNOG – „Qualität auf höchstem Niveau“
Erwartungen nicht enttäuscht, Befürchtungen nicht bestätigt: Die vor zehn Jahren beschlossene frühe Nutzenbewertung hat kumulativ Einsparungen von 9,5 Milliarden Euro gebracht. Sie sichert zugleich für Patienten den frühen Zugang zu Innovationen.
Veröffentlicht:
Das AMNOG schlägt eine Brücke zwischen gesundheits- und industriepolitischen Zielen und sichert den Zugang von Patienten zu Innovationen.
© Aycatcher / stock.adobe.com
Lob von neutraler Seite: „Das AMNOG zeichnet sich durch Exzellenz aus: in Bezug auf seine Methodik, Prozesse und Strukturen – das ist Qualität auf höchstem Niveau. Das AMNOG versucht eine Brücke zwischen gesundheits- und industriepolitischen Zielsetzungen zu schlagen“, schreibt Dr. Sabine Vogler vom WHO-Kooperationszentrum für Arzneimittelpreisbildung und -erstattung in Wien in einem Beitrag für den DAK-AMNOG-Report 2020.
In dem am Donnerstagabend veröffentlichen Report ziehen der Bielefelder Gesundheitsökonom Professor Wolfgang Greiner, seine Mitarbeiter und prominente Gastautoren eine Zehn-Jahres-Bilanz der frühen Nutzenbewertung.
Damit hätte kaum jemand gerechnet: Der erste liberale Gesundheitsminister der Bundesrepublik, Philipp Rösler, schließt die letzte Lücke der Preisregulierung auf dem deutschen Arzneimittelmarkt. Sieben Jahre lang hatte sich seine Vorgängerin Ulla Schmidt (SPD) gemüht, Kosten-Nutzen-Bewertungen zu etablieren – erfolglos.
Im November 2010 beschloss der Bundestag das AMNOG; am 1. Januar 2011 trat es in Kraft und wurde bereits wenige Monate später konsequent umgesetzt – auch dies ein Novum an Performance der Selbstverwaltung.
Zwei grundsätzlich getrennte Verfahrensschritte
© Springer Medizin Verlag
Das Verfahren besteht aus zwei Schritten:
der frühen Nutzenbewertung auf der Basis eines Hersteller-Dossiers, das vom IQWiG begutachtet wird; dessen Empfehlung ist Grundlage des GBA-Beschlusses über das Ausmaß des Zusatznutzens im Vergleich zu einer Vergleichstherapie, oft differenziert nach Teilindikationen/Subpopulationen;
der Bildung eines Erstattungsbetrages, verhandelt von GKV-Spitzenverband und Hersteller, auf Basis des GBA-Beschlusses; bei Nichteinigung entscheidet eine Schiedsstelle; spätestens zwölf Monate nach Markteintritt muss es einen Erstattungsbetrag geben; erst dagegen kann geklagt werden.
Weltweit einmalig am AMNOG ist die Innovationsoffenheit: Unmittelbar nach der Zulassung hat der Hersteller den Marktzugang, die Innovation steht für den Patienten zur Verfügung. Gesichert wird dies dadurch, dass der Hersteller im ersten Jahr der Vermarktung den Preis autonom setzt – ein Prinzip, das von Krankenkassen immer wieder kritisiert wird.
Die Bilanz kann sich sehen lassen:
- In 439 Verfahren wurden bis Ende 2019 265 neue Wirkstoffe bewertet; 39 Prozent der Verfahren sind Zweitbewertungen aufgrund neuer Erkenntnisse oder Befristungen.
- 64 Prozent der Wirkstoffe erhielten einen Zusatznutzen anerkannt; bezogen auf Teilpopulationen 38 Prozent.
- In 83 Prozent der Verfahren wurden Erstattungsbeträge durch Verhandlungen vereinbart; in sechs Prozent entschied die Schiedsstelle, in elf Prozent kam es zu Marktrücknahmen.
- Die Einsparungen kumulieren auf fast 9,5 Milliarden Euro nach IQVIA-Daten; allein 2019 waren es 3,15 Milliarden Euro.
Als lernendes System wurden die gesetzlichen Rahmenbedingungen mehrfach angepasst. Maßgebliche Neuerungen waren der Verzicht auf eine nachträgliche Bewertung des Bestandsmarktes vor 2011 zugelassener noch patentgeschützter Arzneimittel, die Einführung einer 50-Millionen-Euro-Grenze, ab der Orphan Drugs ihren Sonderstatus verlieren.
Maßgeblich war auch die Einführung einer Begleitforschung für Arzneimittel mit nicht befriedigender Evidenzlage und aktuell die Schaffung eines elektronischen Arztinformations-Systems (AIS) mit dem Ziel, Erkenntnisse aus der Nutzenbewertung stringenter in der Verordnungspraxis umzusetzen. Wie intensiv das Parlament die AMNOG-Praxis begleitet hat, zeigt die Zahl von 22 parlamentarischen Anfragen im Bundestag.
Votum des Bundessozialgerichts zum Mischpreis
Fünfmal hat sich das Bundessozialgericht mit dem AMNOG befasst, der prominenteste Fall war der Streit um die Zulässigkeit des Mischpreises bei Teilpopulationen mit und ohne Zusatznutzen und der bei seiner Bildung mögliche Ermessensspielraum der Schiedsstelle. Das Votum der Richter: Der Mischpreis ist zulässig, aber er entbindet die Ärzte nicht der Verantwortung für die Wirtschaftlichkeit im Einzelfall.
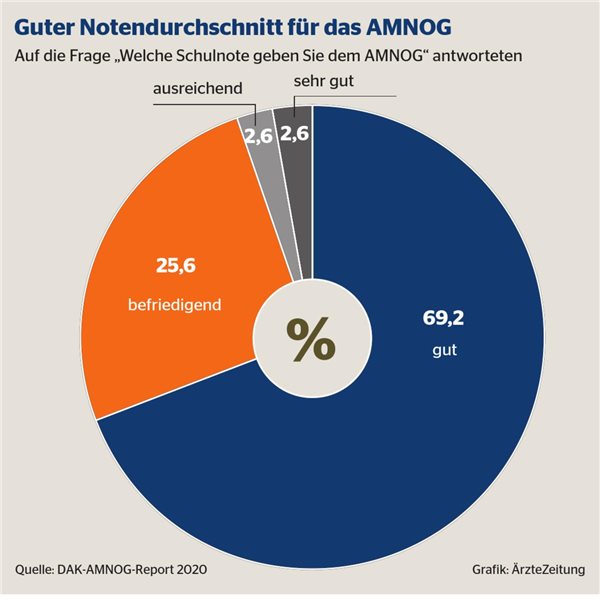
Im Unterschied zur Startphase gilt das AMNOG-Verfahren heute als gut akzeptiert, wie eine Umfrage des DAK-Reports unter 39 Stakeholdern aus Kassen, Industrie und KVen zeigt: 69 Prozent vergeben die Schulnote „gut“, weitere 26 Prozent „befriedigend“. Jeweils über 90 Prozent halten den Bewertungs- und Preisbildungsprozess für wissenschaftlich fundiert und transparent, zwischen 80 und 90 Prozent betonen Fairness und Planbarkeit.
„Alles in allem zeigt sich das AMNOG-Verfahren als lernendes System, das sich in den vergangenen zehn Jahren bewährt hat“, resümiert der Vorstandsvorsitzende der DAK, Andreas Storm.