Europäische Arzneimittelbehörde
Zulassung von Remdesivir bei COVID-19 verzögert sich
Eigentlich hatte die Europäische Arzneimittelbehörde mit einer Entscheidung bis Ende Mai gerechnet. Bisher hat das Unternehmen Gilead aber keinen Zulassungsantrag für Remdesivir bei COVID-19 gestellt.
Veröffentlicht: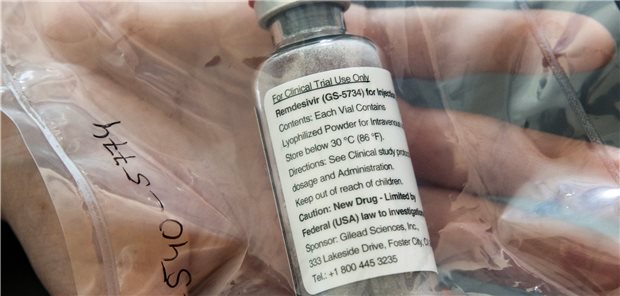
Eine vor Kurzem publizierte Studie hatte eine moderate Wirksamkeit von Remdesivir bei COVID-19 ergeben.
© Ulrich Perrey/dpa
Amsterdam. Die Zulassung des Mittels Remdesivir gegen COVID-19 auf dem europäischen Markt verzögert sich. Das Unternehmen Gilead habe bisher noch keinen Zulassungsantrag gestellt, teilte die Europäische Arzneimittelbehörde EMA mit. Damit werde aber in Kürze gerechnet. Je nach Qualität der vorliegenden Daten sollte dann schnell eine Entscheidung fallen. Die EMA hatte zunächst mit einer Entscheidung bis Ende Mai gerechnet.
Ausnahmegenehmigung in den USA
Am 30. April hatte die EMA ein beschleunigtes Zulassungsverfahren für Remdesivir gestartet. Davon war der erste Zyklus am 15. Mai beendet worden, wie die EMA mitteilte. Ergebnisse von Studien würden ausgewertet und das Mittel mit Blick auf unerwünschte Wirkungen und Nutzen bewertet.
Die USA hatten bereits Anfang Mai eine Ausnahmegenehmigung für den begrenzten Einsatz des ursprünglich zur Behandlung von Ebola entwickelten Wirkstoffes in Krankenhäusern erteilt. Auch in Deutschland ist das Mittel innerhalb eines Arzneimittel-Härtefallprogrammes zugänglich und wird in klinischen Studien getestet.
Studie zeigt moderate Wirksamkeit
Eine internationale Studie mit über 1000 Teilnehmern hatte ergeben, dass Remdesivir bei COVID-19-Patienten die Zeit bis zu einer Genesung im Schnitt um vier Tage verkürzen kann. Die Resultate deuten zudem auch auf einen leichten Überlebensvorteil hin: Die Mortalität innerhalb von 14 Tagen betrug in der Remdesivir-Gruppe 7,1 Prozent und in der Placebo-Gruppe 11,9 Prozent. Der Unterschied war allerdings statistisch nicht signifikant.
Remdesivir ist bislang in keinem Land der Welt uneingeschränkt als Medikament zugelassen. Bislang gibt es keine medikamentöse Therapie bei COVID-19, mehrere Kandidaten befinden sich aber in der Erprobung. (dpa/bae)