Arzneien
Schnelle Zulassung bleibt eine Ausnahme
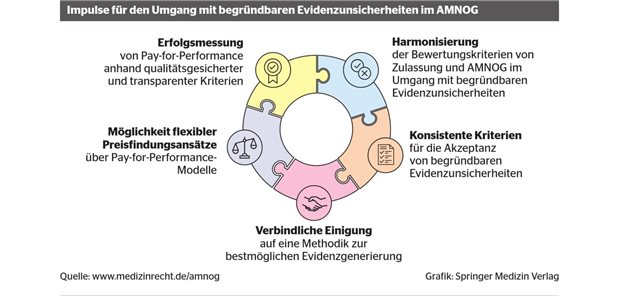
"Adaptive Pathways", ein neues Modell der EMA für eine beschleunigte Arzneizulassung, wird wohl eine Ausnahme bleiben.
Veröffentlicht:BERLIN. Arzneimittelinnovationen schneller für Patienten zugänglich zu machen - das ist das Ziel der Zulassungsbehörden FDA in den USA und neuerdings auch der European Medicines Agency (EMA).
Zusätzlich zu den Möglichkeiten der konditionierten Zulassung und des Compassionate Use - das ist der ausnahmsweise Einsatz von noch nicht zugelassenen Arzneimitteln in besonders dringenden Fällen - hat die EMA im Frühjahr die Anforderungen an das klinische Entwicklungsprogramm und die Zulassungsbedingungen auf der Basis geltenden Rechts neu organisiert.
So werden beispielsweise, wie Professor Lothar Bergmann, Onkologe an der Uni Frankfurt, erläuterte, kleine Patientengruppen molekular identifiziert, bei denen mit hoher Wahrscheinlichkeit eine innovative Therapie anspricht. Das erlaubt überlappende Phase-II- und -III-Studien mit wesentlich kleineren Populationen.
Ganz wesentlich, so betonte Dr. Jan Müller-Berghaus, komme es darauf an, das der pharmazeutische Unternehmer sehr frühzeitig - vor Planung der klinischen Studien - sowohl mit den Zulassungsbehörden als auch den HTA-Institutionen wie dem Gemeinsamen Bundesausschuss in Kontakt trete und dabei die Methoden zum Nachweis der therapeutischen Überlegenheit vereinbare. Dies sei auch entscheidend dafür, dass die beschleunigte Zulassung am Ende auch von den HTA-Institutionen anerkannt werde.
Der Gemeinsame Bundesausschuss verfügt auf der Basis von insgesamt 170 Nutzenbewertungen über gewisse Erfahrungen mit bedingten Zulassungen. In den letzten fünfeinhalb Jahren betraf dies 17 Arzneimittel.
Davon hatten, so Dr. Florian Jantschak vom GBA, vier keinen Zusatznutzen, bei fünf Arzneimitteln war er gering, bei einem beträchtlich und bei sieben nicht quantifizierbar. Ein großer Teil der zu beurteilenden Arzneimittel seien Orphan Drugs gewesen, bei denen der Zusatznutzen von Gesetzes wegen unterstellt wird.
Für die Verhandlungen über einen Erstattungsbetrag seien die vorliegenden Erkenntnisse "nicht befriedigend", so Jantschak. Notwendig seien die Begrenzung der Anwendung solcher Arzneimittel auf spezielle Zen-tren und die Auflage zu weiteren Studien. (HL)