Bewerber für Galenus-Preis 2019
Lynparza® – verlangsamt Progression von rezidivierten Ovarialkarzinomen
Olaparib (Lynparza®) von AstraZeneca bewirkt eine ausgeprägte Verlängerung des progressionsfreien Überlebens bei Patientinnen mit rezidiviertem, schlecht differenziertem („high-grade“) Ovarialkarzinom, die zuvor auf eine Platin-basierte Chemotherapie angesprochen haben. Zudem wird auch das Gesamtüberleben verlängert.
Veröffentlicht: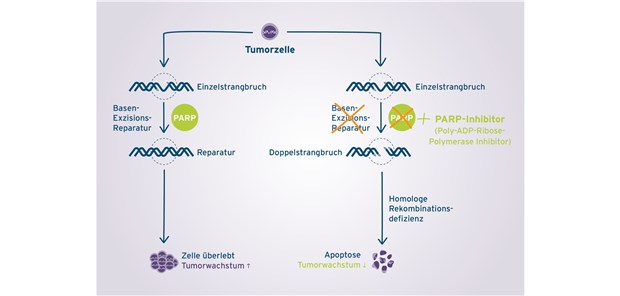
Das Ovarialkarzinom ist in Industrienationen die fünfthäufigste Tumorerkrankung bei Frauen. Ein besonders hohes Erkrankungsrisiko haben Frauen mit einer somatischen oder Keimbahnmutation im BRCA (BReast CAncer)-Gen 1 oder 2.
Bei den meisten Patientinnen mit neu diagnostiziertem Ovarialkarzinom kommt es nach initial gutem Ansprechen auf Platin-basierte Chemotherapien zu Rezidiven. Von Rezidiv zu Rezidiv erreichen sie mit Chemotherapie immer kürzere therapiefreie Intervalle. Daher besteht ein hoher Bedarf an neuen Therapien, die die Langzeitkontrolle beim rezidivierten Ovarialkarzinom substanziell verlängern können.
Neue Therapiestrategie
Olaparib (Lynparza®) von AstraZeneca eröffnete als erster beim Ovarialkarzinom zugelassener PARP (Poly-Adenosinphosphat-Ribose-Polymerase)-Inhibitor eine neue Behandlungsstrategie. Olaparib ist in Deutschland seit Juni 2015 als 50-mg-Hartkapseln auf dem Markt. Seit Juni 2018 sind außerdem Filmtabletten mit 100 mg und 150 mg des Wirkstoffs verfügbar. Die Filmtabletten erleichtern den Patientinnen die Therapie: Statt zweimal täglich acht Hartkapseln beträgt die Dosis nur noch zweimal täglich zwei 150-mg-Filmtabletten.Olaparib-Filmtabletten können unabhängig vom BRCA-Mutationsstatus als Mono-Erhaltungstherapie bei erwachsenen Patientinnen mit Platin-sensitivem Rezidiv eines high-grade epithelialen Ovarialkarzinoms, Eileiter- oder primären Peritonealkarzinoms eingesetzt werden, die auf eine Platin-basierte Therapie partiell oder vollständig ansprechen. Die Zulassung der Substanz unabhängig vom BRCA-Mutationsstatus beruht auf den Ergebnissen der Phase-II-Studie 19 und der Phase-III-Studie SOLO-2.
An der randomisierten doppelblinden Studie 19 nahmen 265 Patientinnen mit rezidiviertem high-grade Ovarialkarzinom teil, die zuvor mindestens zwei Platin-basierte Chemotherapien bekommen und auf die letzte Chemotherapie mit einer partiellen oder kompletten Remission angesprochen hatten. Die Frauen erhielten eine Erhaltungstherapie mit zweimal täglich 400 mg Olaparib als Hartkapseln zu je 50 mg (n = 136) oder Placebo (n = 129).
Unter Olaparib kam es im Vergleich zu Placebo zu einer signifikanten Verlängerung des progressionsfreien Überlebens (PFS; primärer Endpunkt) auf 8,4 versus 4,8 Monate (p < 0,001). Zudem war das Risiko für eine Krankheitsprogression oder Tod im Vergleich zu Placebo um 65 Prozent reduziert (p < 0,001). Dieser PFS-Vorteil ließ sich konsistent für alle untersuchten Subgruppen nachweisen. Den größten PFS-Vorteil hatten dabei Frauen mit BRCA- gegenüber Frauen ohne BRCA-Mutation (11,2 versus 4,3 Monate, p < 0,001).
Ein Update der Studie 19 ergab nach mehr als fünfjähriger Beobachtungszeit ein höheres medianes Gesamtüberlebens im Olaparib-Arm von 29,8 versus 27,8 Monaten im Placebo-Arm (p = 0,025).
Deutliche Verlängerung des PFS
Die SOLO-2-Studie wurde initiiert, um die Ergebnisse der Studie 19 auf Phase-III-Niveau zu bestätigen. Zudem sollte Olaparib als Filmtabletten geprüft werden. In dieser randomisierten, doppelblinden Studie wurden 295 Frauen mit rezidiviertem, Platin-sensitivem, high-grade serösem Ovarialkarzinom, high-grade Eileiterkarzinom oder primärem Peritonealkarzinom mit zweimal täglich 300 mg Olaparib (n = 196), oder Placebo (n = 99) behandelt. Alle Patientinnen hatten zuvor mindestens zwei Platin-basierte Therapielinien erhalten und hatten nach der letzten Chemotherapie eine partielle oder komplette Remision. Alle Frauen wiesen eine BRCA-1- oder BRCA-2-Mutation auf.Olaparib verlängerte das mediane PFS signifikant auf 19,1 Monate (Placebo: 5,5 Monate; p < 0,001). Laut Beurteilung durch unabhängige Experten betrug der PFS-Vorteil gegenüber Placebo sogar 30,2 versus 5,5 Monate (p < 0,001). Das PFS war somit erheblich ausgeprägter als in Studie 19.
In der SOLO-2-Studie vergingen bis zum Beginn der nächsten Therapie in der Olaparib-Gruppe 27,9 Monate. Dagegen benötigten die Patienten der Placebo-Gruppe bereits nach 7,1 Monaten eine Anschlusstherapie.
Lebensqualität bleibt erhalten
Wie die Analyse der Patient Reported Outcomes (eine Erhebung der von den Patienten berichteten Symptome und Angaben zur Lebensqualität) ergab, unterschieden sich die beiden Gruppen nicht in der Lebensqualität.Schwere Nebenwirkungen traten im Olaparib-Arm bei 18 Prozent der Patientinnen auf, im Placebo-Arm bei 8 Prozent. Die häufigsten schweren Nebenwirkungen unter Olaparib waren Anämie (4 Prozent), Abdominalbeschwerden (2 Prozent) und Darmverschluss (2 Prozent). Aufgrund des insgesamt günstigen Nebenwirkungsprofils konnten die meisten Patientinnen die Erhaltungstherapie in voller Dosierung durchführen. (spg)