COVID-19
USA erlauben begrenzten Einsatz von Corona-Wirkstoff Remdesivir
In den USA hat die Arzneimittelbehörde FDA aufgrund erster Daten einer großen Studie nun das Medikament Remdesivir bei Patienten mit COVID-19 bfür den begrenzten Einsatz zugelassen. Wie sehen das deutsche Ärzte?
Veröffentlicht: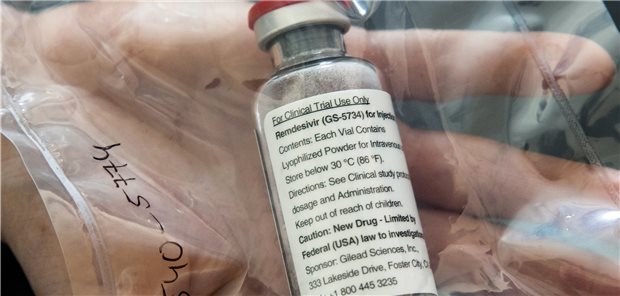
Hoffnungsschimmer gegen COVID-19: Eine Ampulle des Medikamentes Remdesivir.
© picture alliance/dpa
Washington. Die USA erlauben den begrenzten Einsatz des Wirkstoffs Remdesivir bei COVID-19-Patienten in Krankenhäusern. Eine klinische Studie hatte zuvor gezeigt, dass der ursprünglich für Ebola entwickelte Wirkstoff bei Covid-Patienten die Zeit bis zu einer Genesung um mehrere Tage verkürzen kann. Die rasche Zulassung sei extrem ungewöhnlich – und nicht gänzlich unproblematisch, sagen deutsche Experten.
Die Anwendung unterliegt allerdings strengen Vorgaben. So darf die Substanz laut FDA nur bei Erwachsenen und Kindern mit schweren Symptomen angewendet werden, definiert durch Kriterien wie einer Sauerstoffsättigung unter 94 Prozent, und Bedarf an Sauerstoff und mechanischer Beatmung bzw. ECMO. Remdesivir wird intravenös verabreicht nach fest definierten Dosierungsschemata.
Corona-Therapie
Remdesivir beschleunigt Genesung bei COVID-19
Die Ausnahmegenehmigung der FDA sei angesichts der Coronavirus-Pandemie „in Lichtgeschwindigkeit“ zustande gekommen, hatte der Chef der US-Lebensmittel- und Arzneimittelbehörde FDA, Stephen Hahn, am Freitag im Weißen Haus gesagt. Präsident Donald Trump bezeichnete den Schritt als „sehr vielversprechend“.
Der Chef des Biotech-Unternehmens Gilead, Daniel O’Day, erklärte, das Unternehmen werde US-Behörden 1,5 Millionen Dosen Remdesivir spenden, die für mehr als 100.000 Behandlungen ausreichen sollten. Patienten, die an COVID-19 litten, könnten das Medikament nun je nach Schwere der Erkrankung fünf oder zehn Tage lang bekommen, erklärte Gilead. Die US-Regierung werde die Verteilung des Medikaments übernehmen, um sicherzustellen, dass es ankomme, wo es am dringendsten gebraucht werde. Bis Dezember wolle man genügend Remdesivir für eine Million Behandlungen produzieren.
Die begrenzte Ausnahmegenehmigung für Remdesivir in den USA entspricht keiner formellen Zulassung, ist aber nach nur einer vielversprechenden klinischen Studie, dennoch ungewöhnlich. Am Mittwoch hatte das Nationale Institut für Infektionskrankheiten (NIAID) der USA erklärt, Remdesivir habe im Rahmen einer klinischen Studie die Behandlungsdauer deutlich verkürzt. Institutsleiter Anthony Fauci sprach von einer „signifikanten positiven Wirkung bei der Verringerung der Zeit bis zur Genesung“.
Remdesivir-Effekte: Zwischen Optimismus und Skepsis
Die ungewöhnlich schnelle Erteilung der Ausnahmegenehmigung ist nach Ansicht des deutschen Medizinethikers Peter Dabrock vertretbar. Allerdings müssten wichtige Bedingungen erfüllt sein. So dürften die vorliegenden Daten keine Hinweise darauf geben, dass die Anwendung ohne Nutzen ist, und sie müssten zeigen, dass die Nebenwirkungen akzeptabel sind. Zudem müssten die Patienten oder ihre gesetzlichen Vertreter in die Behandlung einwilligen. „Wenn das gegeben ist, scheint mir die Zulassung in einer weltgesellschaftlichen Notsituation wie dieser verantwortbar zu sein“, sagte der ehemalige Vorsitzende des Deutschen Ethikrates.
Privatdozent Dr. Christoph Spinner, Infektiologe am Münchner Klinikum Rechts der Isar, der mit Remdesivir gearbeitet hat, zeigte sich ebenfalls optimistisch. Remdesivir sei das erste Arzneimittel, das in Studien einen positiven Einfluss auf den Verlauf von Covid-19 gezeigt hat. „Das ist mehr als ein Anfang“, äußerte erin den „tagesthemen“.
Als „extrem ungewöhnlich“ beurteilt Professor Gerd Fätkenheuer die Entscheidung der US-Zulassungsbehörde. Der Mediziner von der Uniklinik Köln hat den deutschen Teil der Studie geleitet. Aus drei Studienzentren wurden Daten von 13 Patienten zugeliefert. Die Daten der jetzt vorliegenden Zwischenbegutachtung zeigten eine erste Wirkung von Remdesivir, aber wichtige Fragen seien noch offen. So fehlten Angaben zu Nebenwirkungen, und es sei nicht klar, welche Patienten am ehesten von einer Behandlung profitieren. Auch der Einfluss auf die Sterblichkeit sei noch nicht sicher zu beurteilen. „Ich sehe das von daher insgesamt kritisch.“
BfArM-Härtefallprogramm für Remdesivir
In Deutschland hat das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) Anfang April ein sogenanntes Arzneimittelhärtefallprogramm für Remdesivir bestätigt. Damit dürfen Patienten das noch nicht zugelassene Mittel erhalten. Derzeit habe das BfArM insgesamt vier klinische Prüfungen mit Remdesivir zur Behandlung von COVID-19 genehmigt.
Die US-Studie mit mehr als 1000 Teilnehmern ist nach Angaben der NIAID mit Kontrollgruppen durchgeführt worden, die Datenerhebung hätten unabhängige Experten begleitet. Patienten mit der vom Coronavirus verursachten Lungenkrankheit Covid-19 waren Fauci zufolge nach durchschnittlich 11 Tagen wieder genesen, die Patienten der Kontrollgruppe hingegen erst nach 15 Tagen. Die Resultate müssten noch unabhängig geprüft und veröffentlicht werden, schränkte Fauci ein. Zudem führte das Medikament nur zu einer geringfügig niedrigeren Sterblichkeitsrate.
Eine ebenfalls diese Woche im Fachmagazin „The Lancet“ vorgestellte chinesische Studie kam hingegen zu dem Schluss, dass sich der Zustand der Patienten mit Remdesivir nicht wesentlich verbessert. Aus Patientenmangel wurde diese Studie allerdings frühzeitig abgebrochen. Zudem waren die meisten dieser Patienten erst spät im Krankheitsverlauf mit Remdesivir behandelt worden. (dpa)