Unliebsame Wegbegleiter
Ursprung des Hepatitis-B-Virus in Fischen entdeckt
Eine neue Virusfamilie, die Forscher im Erbgut von Fischen nachgewiesen haben, gibt Einblick in die Herkunft des Hepatitis-B- Virus. Der Vorläufer des heutigen HBV folgte der Evolution des Lebens dabei quasi auf Schritt und Tritt.
Veröffentlicht: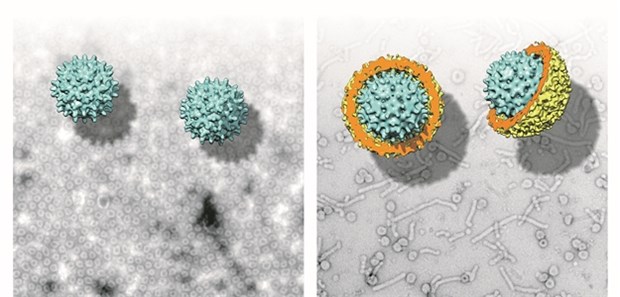
EM-Aufnahmen und 3D-Modelle von Nackednaviren (links) und dem humanen Hepatitis-B-Virus (rechts).
© Universitätsklinikum Heidelberg
HEIDELBERG. Auch unliebsame Begleiter können treue Weggefährten sein: Wie Wissenschaftler des Uniklinikums Heidelberg berichten, folgten Vorläufer des heutigen Hepatitis-B-Virus (HBV) der Evolution des Lebens quasi auf Schritt und Tritt.
Der Weg begann, als ein Vorfahre dieser Viren sich vor rund 430 Millionen Jahren in zwei Gruppen aufspaltete: Aus einer entwickelten sich die bekannten Hepadnaviren, die eine Hülle tragen und zu denen auch das HBV zählt (Cell H Micr 2017; online 31. August).
Aus dem zweiten Ast des Stammbaums ging eine in Fischen neu entdeckte Familie hervor, die keine Hülle hat und deshalb in Anspielung auf den schwäbischen Dialekt "Nackednaviren" getauft wurde.
Die entscheidende Veränderung nach der Aufspaltung beider Linien war die Entstehung eines neuen Gens in der Gruppe der Hepadnaviren, welches den Viren ihre Hülle und damit eine ausgeprägte Spezifität für die Leber verleiht.
Die Heidelberger Forscher vermuteten, dass die Hepadnaviren aus einem primitiveren Virus ohne Hüllprotein-Gen entstanden sind, indem ein Stück fremde DNA zufällig in das Virus-Genom "gesprungen" ist.
Virologische Detektivarbeit
Um diese Theorie zu untermauern, begann eine Art virologischer Detektivarbeit, wie die Uni Heidelberg berichtet. Das Team um Dr. Stefan Seitz entwarf ein Modell, wie das Genom eines hüllenlosen Vorläufervirus aufgebaut sein müsste.
Die Wissenschaftler durchsuchten dann über 25.000 Sequenzierprojekte von Fischen nach Gensequenzen, die den hüllenlosen Vorläufern von HBV entsprechen könnten.
Sie entdeckten entsprechende Genome in 13 völlig unterschiedlichen Fischarten, die heute weltweit verbreitet sind. Weitere Analysen brachten noch eine entscheidende Erkenntnis für die Evolution der Virusfamilien: Es zeigte sich, dass die umhüllten Hepadnaviren nicht nur in Säugetieren und Vögeln vorkommen – wie lange vermutet –, sondern auch in Amphibien und Reptilien.
Um herauszufinden, in welchem zeitlichen Zusammenhang die Virusarten zueinanderstehen, wendeten die Wissenschaftler einen weiteren Kunstgriff an: Sie suchten in der Gruppe der Neoaves – die alle heutigen Vögel außer Hühnervögeln, Enten- und Straußenartigen umfasst – nach Spuren eines Virus, das vor Beginn der explosiven Entwicklung dieser Tiergruppe vor rund 69 Millionen Jahren in das Wirtsgenom integriert und sozusagen als blinder Passagier an alle Nachkommen vererbt wurde.
Koevolutionen bei Virus und Wirt
Da das Alter dieser Tiergruppe mit hoher Genauigkeit bestimmt wurde, ließ sich mittels dieses urtümlichen, im Wirtsgenom quasi "fossilisierten" Vogelvirus der gemeinsame Stammbaum der Hepadnaviren und der Nackednaviren zeitlich kalibrieren.
Es habe sich dabei auf verblüffende Weise gezeigt, dass die Verzweigungen im Stammbaum auf der Seite der Hepadnaviren zeitlich aufs Engste den Verzweigungen im Stammbaum der jeweiligen Wirtstiere entsprechen, heißt es in der Mitteilung.
"Es gibt eindeutig eine Koevolution zwischen Virus und Wirt", fasst Seitz die Forschungsergebnisse zusammen und resümiert: "Letztendlich tragen wir Menschen mit dem HBV den Nachfahren eines Fisch-Virus in uns, der uns seit vielen Millionen Jahren begleitet."
Hülleentwicklung entscheidend
Die Entwicklung einer Hülle stellte dabei die entscheidende Weiche für die Gruppe der Hepadnaviren: Die Hüllproteine erkennen nach dem Schlüssel-Schloss-Prinzip ganz bestimmte, aber von Wirt zu Wirt unterschiedliche Rezeptormoleküle auf der Oberfläche von Leberzellen.
Ein Wechsel zwischen verschiedenen Wirtstierarten ist den Hepadnaviren deshalb nur selten möglich. Die Vorteile überwiegen jedoch: "Die Hülle erleichtert den Viren den Eintritt in die Zelle, weil sie mit der Zellmembran des Wirts verschmelzen. Hüllenlose Viren haben es wesentlich schwerer, in die Zelle hineinzugelangen", so Seitz.
Auch gebe es Hinweise, dass die Hüllproteine das HBV dabei unterstützen, sich gegen das Immunsystem des Wirts zu wehren. (eb)